 |
Раскисление и легирование стали
|
|
|
|
Раскисление – это процесс удаления излишнего кислорода из металла различными способами.
Легирование – это операция присадки в сталь легирующих элементов для придания ей каких-либо особых физико-химических или механических свойств (твёрдость, жаропрочность и т.д.)
Перед раскислением в металле содержится (с учётом выхода стали – 0,9), кг:
Углерода – 0,387; серы – 0,0207; марганца – 0,072; фосфора – 0,0135.
Концентрация растворенного в металле кислорода к концу продувки зависит от факторов: от содержания углерода в металле, оксидов железа в шлаке и от температуры металла.
Концентрацию кислорода в металле под шлаком с содержанием 16 – 20% (FeO + Fe2O3) с основностью 2,4 при температуре ванны 1665 °С находим по формуле Г.Н. Ойкса
[%C] * [% O] = 0,0035 + 0,006 * [% C],
откуда
[% O] =  =
= 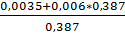 = 0,015 %
= 0,015 %
Или  = 0,014 кг
= 0,014 кг
Раскисление стали производим присадками ферросилиция и ферромарганца в ковш. Коэффициент усвоения Si при раскислении принимаем 0,70%, коэффициент усвоения Mn из ферромарганца – 0,75%, коэффициент усвоение С – 0,7
Расход ферросилиция – 65 определяем по формуле:
Р =  кг
кг
Где а – требующееся для ввода в металл количество кремния, равное среднему значению в данной марки стали, минус остаточное содержание кремния в металле перед раскислением (в данном случае 0,230 - 0,00 = 0,230); b – содержание кремния в 1 кг ферросилиция, кг; с – коэффициент усвоения кремния в металле (0,7).
РFeSi =  = 0,505 кг
= 0,505 кг
Это количество ферросилиция содержит, кг:
Si = 0,505 * 0,6512 = 0,329
Mn = 0,505 * 0,004 = 0,002
P = 0,505 * 0,0005 = 0,00025
S = 0,505 * 0,0003 = 0,00015
Fe = 0,505 * 0,344 = 0,174
Σ = 0,505 кг
Выгорает, кг:
Si – 30% Mn – 25%
Mn = 0,002 * 0,25 = 0,0005
Si = 0,329 * 0,30 = 0,099
Переходит в сталь, кг:
Si = 0,329 – 0,099 = 0,230
Mn = 0,002 – 0,0005 = 0,0015
P = 0,00025
S = 0,00015
Fe = 0,174
 Σ = 0,406
Σ = 0,406
Требуется кислорода на окисление примесей, кг:
|
|
|
 Si
Si  SiO2 = 0,099 * 32/28 = 0,113
SiO2 = 0,099 * 32/28 = 0,113
Mn  MnO = 0,0005 * 16/55 = 0,00015
MnO = 0,0005 * 16/55 = 0,00015
Σ = 0,1132
Поступит кислорода из атмосферы: 0,1132 кг.
Выход стали, после раскисления ферросилицием составит:
93,6834 + 0,406 = 94,0894 кг
Получится оксидов, кг:
SiO2 = 0,099 + 0,113 = 0,212
MnO = 0,0005 + 0,00015 = 0,00065
Выход шлака:
3,9510 + 0,212 + 0,00065 = 4,164 кг
На основании полученных в расчетах данных составляем материальный баланс плавки после раскисления ферросилицием
Количество стали перед раскислением с учетом растворенного кислорода:
93,6834 – 0,015 = 93,6684 кг
Таблица 11 - Материальный баланс плавки после раскисления FeSi
| Поступило, кг | Получено, кг | ||
| Стали до раскисления | 93,6834 | Стали | 94,0894 |
| Шлака до раскисления | 3,9510 | Шлака | 4,1640 |
| Ферросилиция | 0,505 | ||
| Кислорода из атмосферы | 0,1132 | ||
| Σ | 98,2526 | Σ | 98,2534 |
| Невязка = 0 |
Таблица 12 - Химический состав стали после раскисления FeSi
| Наименование | Si | С | Mn | P | S | Fe | Σ |
| Металл перед раскислением | - | 0,387 | 0,072 | 0,0135 | 0,0207 | 93,1902 | 93,6834 |
| FeSi вносит | 0,230 | - | 0,0015 | 0,00025 | 0,00015 | 0,174 | 0,406 |
| Всего, кг % | 0,230 | 0,387 | 0,0735 | 0,0138 | 0,0209 | 93,3642 | 94,0894 |
| 0,24 | 0,41 | 0,08 | 0,01 | 0,02 | 99,24 |
В стали перед вводом ферромарганца содержится, кг:
Углерода – 0,387; фосфора – 0,0138; марганца – 0,0735; серы – 0,0209; кремния - 0,230.
Определяем расход ферромарганца на 100 кг шихты:
а = 0,775 – 0,08 = 0,695
Р =  = 1,182 кг
= 1,182 кг
Это количество ферромарганца содержит, кг:
 С = 1,182 * 0,005 = 0,006
С = 1,182 * 0,005 = 0,006
Mn = 1,182 * 0,7837 = 0,926
Si = 1,182 * 0,012 = 0,014
P = 1,182 * 0,0003 = 0,00035
S = 1,182 * 0,0001 =0,00012
Fe = 1,182 * 0,1989 = 0,235
Σ = 1,182
Выгорает, кг:
С = 30% Mn = 25% Si = 30%
С = 0,006 * 0,3 = 0,0018
Mn = 0,926 * 0,25 = 0,2315
Si = 0,014 * 0,30 = 0,0042
Переходит в сталь, кг:
С = 0,006 – 0,0018 = 0,0042
Mn = 0,926 – 0,2315 = 0,6945
Si = 0,014 – 0,0042 = 0,0098
P = 0,00035
S = 0,00012
Fe = 0,235
 Σ = 0,944
Σ = 0,944
Требуется кислорода на окисление примесей, кг:
 C
C  CO = 0,0018 * 16/12 = 0,0024
CO = 0,0018 * 16/12 = 0,0024
Mn  MnO = 0,2315 * 16/55 = 0,0673
MnO = 0,2315 * 16/55 = 0,0673
Si  SiO2 = 0,0042 * 32/28 = 0,0048
SiO2 = 0,0042 * 32/28 = 0,0048
Σ = 0,0745
Поступит кислорода из атмосферы - 0,0745 кг
Выход стали, после раскисления ферромарганцем будет:
94,0894 + 0,944 = 95,0334 кг
Получится оксидов, кг:
|
|
|
СО = 0,0018 + 0,0024 = 0,0042
MnO = 0,2315 + 0,0673 = 0,2988
SiO2 = 0,0042 + 0,0048 = 0,0090
Выход шлака:
4,1640 + 0,2988 + 0,0090 = 4,4718 кг
На основании полученных в расчетах данных составляем материальный баланс плавки после раскисления ферромарганцем
Таблица 13 - Материальный баланс плавки после раскиления FeMn
| Поступило, кг | Получено, кг | ||
| Стали до раскисления SiMn | 94,0894 | Стали | 95,0334 |
| Шлака до раскисления SiMn | 4,1640 | Шлака | 4,4718 |
| Ферромарганца | 1,182 | СО | 0,0042 |
| Кислорода из атмосферы | 0,0745 | ||
| Σ | 99,5099 | Σ | 99,5094 |
| Невязка = 0 |
Таблица 14 - Химический состав стали после раскисления FeMn
| Наименование | Si | С | Mn | P | S | Fe | Σ |
| Металл перед раскислением | 0,230 | 0,387 | 0,0735 | 0,0138 | 0,0209 | 93,3642 | 94,0894 |
| FeMn вносит | 0,0098 | 0,0042 | 0,6945 | 0,00035 | 0,00012 | 0,235 | 0,944 |
| Всего, кг % | 0,2398 | 0,3912 | 0,768 | 0,0142 | 0,021 | 93,5992 | 95,0334 |
| 0,25 | 0,41 | 0,81 | 0,02 | 0,02 | 98,49 |
Тепловой баланс плавки
В кислородно-конверторном процессе нагрев металла до заданной температуры осуществляется за счет внутренних источников тепла физического и химического тепла чугуна и теплоты шлакообразования.
Согласно заданию даны расход чугуна, их химический состав. Ранее произведены расчёты, необходимые для составления теплового баланса, который содержит приходную и расходную части.
Физическое тепло чугуна:
Q1 = [0,178 * 1200 + 52 + 0,2 * (1383 – 1200)] * 100 * 0,00419 = 126,622 МДж
Где 0,178 – средняя теплоёмкость чугуна до температуры плавления, ккал/кг*град; 1200 – температура плавления чугуна, °С; 52 – скрытая теплота плавления чугуна, ккал/кг; 1383 – температура заливаемого в конвертор чугуна, °С; 0,2 – теплоёмкость жидкого чугуна, ккал/кг*град; 0,00419 – коэффициент перевода ккал в МДж; 100 – доля чугуна в металлошихте, %
Тепло экзотермических реакций, МДж:
 С
С  СО2 = 34,1 * 0,281 = 9,582
СО2 = 34,1 * 0,281 = 9,582
С  СО = 10,47 * 2,532 = 26,510
СО = 10,47 * 2,532 = 26,510
Mn  MnO = 7,37 * 0,053 = 0,391
MnO = 7,37 * 0,053 = 0,391
P  P2O5 = 25 * 0,0105 = 0,263
P2O5 = 25 * 0,0105 = 0,263
S  SO2 = 9,28 * 0,0041 = 0,038
SO2 = 9,28 * 0,0041 = 0,038
Fe  Fe2O3 = 7,37 * 0,088 = 0,649
Fe2O3 = 7,37 * 0,088 = 0,649
Fe  FeO = 4,82 * 0,348 = 1,677
FeO = 4,82 * 0,348 = 1,677
Fe  Fe2O3 (в дым) = 7,37 * 1,5000 = 11,0550
Fe2O3 (в дым) = 7,37 * 1,5000 = 11,0550
∑ = 50,165 МДж
Тепло шлакообразования, МДж: 
Р2О5 = 4,74 * 0,0105 * 142/62 = 0,114
∑ = 0,114 МДж
Приход тепла:
Qприх = 126,622 + 50,165 + 0,114 = 176,901 МДж
Физическое тепло стали:
Q1 = [0,167 * 1500 + 65 + 0,2 * (1665 – 1500) ] * (93,6834 + 0,5 + 1) * 0,00419 = 138,988 МДж
Где 0,167 – средняя теплоемкость стали до температуры плавления, ккал/кг*град; 1500 – температура плавления стали, °С; 65 – скрытая теплота плавления стали, ккал/кг; 0,2 – теплоемкость жидкой стали, ккал/кг*град; 1665 – температура выпуска стали, °С; 93,6834 – выход стали до раскисления, кг; 0,5 и 1 – потери металла с корольками и выбросами соответственно, кг; 0,00419 – коэффициент перевода ккал в МДж.
|
|
|
Физическое тепло шлака:
Q2 = (0,298 * 1665 + 65) * 3,9510 * 0,00419 = 9,290 МДж.
Где 0,298 – средняя теплоемкость шлака, ккал/кг*град; 1665 – температура шлака, °С; 65 – скрытая теплота плавления, ккал/кг; 3,9510 – выход шлака до раскисления, кг.
Потери тепла через футеровку и горловину принимаем равным 5% от прихода:
Q3 = 176,901 * 0,05 = 8,845 МДж
Частицы Fe2O3 выносят тепла:
Q4 = (0,294 * 1450 + 50) * 2,143 * 0,00419 = 4,2767 МДж
Где 0,294 – теплоемкость пыли, ккал/кг*град; 1450 – температура частиц пыли, °С; 2,143 – количество частиц пыли Fe2O3 (в дым), кг.
Газы уносят тепла при средней t = 1450 °С, МДж:
 СО2 = 3,411 * 0,625 = 2,132
СО2 = 3,411 * 0,625 = 2,132
СО = 2,12 * 4,726 = 10,019
Н2О = 2,648 * 0,031 = 0,082
О2 = 2,212 * 0,182 = 0,403
N2 = 2,091 * 0,018 = 0,038
SO2 = 3,411 * 0,0029 = 0,0099
Q5 = 12,684 МДж.
Расход тепла составит:
Qр = 138,988 + 9,290 + 8,845 + 4,2767 + 12,684 = 174,0837 МДж
Избыток тепла:
176,901 – 174,0837 = 2,8173 МДж
По полученным данным составляем тепловой баланс плавки:
Таблица 15 - Тепловой баланс плавки
| Приход тепла | ||
| МДж | % | |
| Физическое тепло чугуна | 126,622 | 71,58 |
| Тепло экзотермических реакций | 50,165 | 28,36 |
| Тепло шлакообразования | 0,114 | 0,06 |
| ИТОГО | 176,901 | |
| Расход тепла | ||
| МДж | % | |
| Физическое тепло: стали | 138,988 | 78,57 |
| шлака | 9,290 | 5,25 |
| Потери тепла через футеровку и горловину | 8,845 | 5,00 |
| Потери тепла с частицами Fe2O3 | 4,2767 | 2,42 |
| Потери тепла с газами | 12,684 | 7,17 |
| Избыток тепла | 2,8173 | 1,59 |
| ИТОГО | 176,901 |
|
|
|
12 |


