 |
Основы механики печных газов. Общая характеристика свойств жидкостей и газов. Газы реальные и идеальные. Движение газов: ламинарное и турбулентное. Давление газов.
|
|
|
|
Механика газов широко использует многие понятия, аналогии и уравнения механики жидкости так называемой гидравлики, сформировавшейся в науке значительно раньше по причине большей наглядности и осязаемости движения жидкости, по сравнению с движением газов. Для математического описания Движения газов приходится прибегать к ряду упрощений, позволяющих уподобить движение печных газов движению капельной Жидкости с небольшой вязкостью, законы которого хорошо изучены в гидравлике. Однако во избежание грубых ошибок при введении упрощающих условий в характеристики и поведение печных газов необходимо ясно представлять различие капельной Жидкости и газов и те неточности и условности, которые вытекают из допускаемой аналогии.
Большинство жидкостей при изменении давления и температуры изменяет свой объем на очень малую величину, вследствие чего капельная жидкость принимается практически несжимаемой. Газы весьма чувствительны к изменению давления и температуры и изменяют свой объем в зависимости от давления по закону Бойля — Марриотта: PV = const; в зависимости от температуры по закону Гей-Люссака: Vt = V0 (1 + р). Учитывая, что в большинстве металлургических печей давление отличается от атмосферного не более чем на 1%, что весьма мало влияет на изменение объема печных газов, в газовой механике принимается независимость объема газов от давления, за исключением некоторых специальных задач, при решении которых нельзя пренебрегать влиянием давления. Влияние температуры на объем печных газов обойти никак нельзя, поэтому оно учитывается по закону Гей-Люссака. Реальные жидкости и газы обладают вязкостью, характеризующейся сопротивлением сдвигу одного слоя по отношению к другому, прилежащему слою. При движении реальных жидкостей и газов приходится преодолевать силу вязкости и совершать необратимую работу, затрачивая на это энергию. Для большинства жидкостей вязкость уменьшается при повышении температуры, а для газов, наоборот, повышается. Идеальной жидкостью или идеальным газом называются такие условные жидкости и газы, у которых отсутствует вязкость и на перемещение их не требуется непрерывно затрачивать энергию. Понятие об идеальном газе облегчает (вывод многих уравнений в газовой механике.
|
|
|
Используя в механике газов подобие жидкости и газа и применяя к газам многие законы гидравлики, следует представлять и некоторые особенности, отличающие горячие печные газы от жидкости. Печные газы вследствие повышенной температуры обладают малым удельным весом по сравнению с окружающим атмосферным воздухом. Это делает их поведение несколько отличным от поведения жидкости. В. Е. Грум-Гржимайло очень образно охарактеризовал это, указав, что доведение печных газов аналогично поведению легкой жидкости, помещенной в среду из тяжелой жидкости. В первой модели печи, достроенной В. Е. Грум-Гржимайло, печные газы изображались керосином в окружающий воздух — водой, для чего прозрачная модель печи, наполненная подкрашенным керосином, целиком помещалась в стеклянный сосуд с водой.
Зависимость между объемом и давлением газа. Зависимость между объемом и давлением для одной и той же массы газа при одной постоянной температуре была открыта английским ученым Бойлем в 1662 г. и французским ученым Мариоттом в 1676 г. и носит название закона Бойля - Мариотта: для данной массы газа при постоянной температуре объем газа изменяется обратно пропорционально давлению.
Процесс, протекающий при постоянной температуре, называется изотермическим (от греческих слов "изос" - равный, "термос" - теплый). Зависимость между объемом и температурой газа. При повышении температуры газа увеличивается скорость движения молекул, что ведет к возрастанию их кинетической энергии. В результате увеличения скорости молекул их удары о стенки сосуда становятся сильнее и чаще, что увеличивает давление.
Если объем газа в сосуде может свободно изменяться при его нагревании, то газ расширится и займет объем, при котором его давление станет равным внешнему давлению. Для данной массы газа при постоянном давлении объем газа изменяется прямо пропорционально абсолютной температуре.
Процесс, протекающий при постоянном давлении газа, называется изобарическим. Зависимость между давлением и температурой газа.Если заключить газ в закрытый сосуд и нагреть его от 0° С до I е С, то объем газа будет оставаться неизменным (расширением сосуда пренебречь), а давление будет увеличиваться.
Зависимость между давлением и температурой газа при постоянном объеме устанавливается законом Шарля, открытым в 1787 г. Абсолютное давление газа при постоянном объеме прямо пропорционально его абсолютной температуре.
Процесс, протекающий при постоянном объеме газа, называется изохорическим ("изос" - равный, "хорема" - вместительность). Пример: Замкнутую систему холодильной установки для проверки на прочность, наполнили воздухом давлением 13-108 Па. При нагнетании в систему температура воздуха повысилась до 48° С. Через 6 ч теплый воздух в системе остынет и примет комнатную температуру, равную 18° С.
Свойства жидкостей. Из многих свойств жидкостей для холодильной техники имеют основное значение свойства текучести, несжимаемости, смачиваемости и капиллярности. В результате текучести жидкость принимает форму того сосуда, в котором она находится. Жидкости практически не сжимаются, т. е. при увеличении давления их объем остается близким к первоначальному.
|
|
|
При соприкосновении жидкостей с твердыми телами наблюдается явление смачивания или несмачивания, например вода смачивает чистое стекло, но не смачивает парафин. Смачивание жидкостью твердых тел происходит тогда, когда сцепление между молекулами твердого тела и жидкостью больше, чем сцепление между молекулами жидкости.
|
|
|
Капиллярность - это распространение жидкости по пористым телам. Например, поднятие керосина по фитилю в лампе, поднятие влаги по капиллярам на поверхность почвы и т. д.
Реальный газ — газ, который не описывается уравнением состояния идеального газа Клапейрона — Менделеева.
Зависимости между его параметрами показывают, что молекулы в реальном газе взаимодействуют между собой и занимают определенный объём. Состояние реального газа часто на практике описывается обобщённым уравнением Менделеева — Клапейрона:
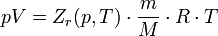
где p — давление; V - объем T — температура; Zr = Zr (p,T) — коэффициент сжимаемости газа; m - масса; М — молярная масса; R — газовая постоянная.
Идеальный газ — математическая модель газа, в которой предполагается, что потенциальной энергией взаимодействия молекул можно пренебречь по сравнению с их кинетической энергией. Между молекулами не действуют силы притяжения или отталкивания, соударения частиц между собой и со стенками сосуда абсолютно упруги, а время взаимодействия между молекулами пренебрежимо мало по сравнению со средним временем между столкновениями.
Модель широко применяется для решения задач термодинамики газов и задач аэрогазодинамики. Например, воздух при атмосферном давлении и комнатной температуре с большой точностью описывается данной моделью. В случае экстремальных температур или давлений требуется применение более точной модели, например модели газа Ван-дер-Ваальса, в котором учитывается притяжение между молекулами.
Ламина́рное тече́ние (лат. lāmina — «пластинка») — течение, при котором жидкость или газ перемещается слоями без перемешивания и пульсаций (то есть беспорядочных быстрых изменений скорости и давления).
До 1917 года в российской науке пользовались термином Струйчатое течение.
Турбулентное движение — движение воздуха, газа или жидкости, характеризующееся тем, что помимо некоторой средней скорости потока его частицы имеют свою добавочную скорость, направление которой отличается от направления средней скорости
Re = v0D/n,
где D - характерный линейный масштаб (например, диаметр трубы);
n - кинематическая вязкость;
v0 - типичное значенние скорости потока.
|
|
|


