 |
Примеры расчетов при стандартизации рабочих растворов ( титрантов)
|
|
|
|
(Взяты из учебного пособия: Калинкин И.П. Титриметрические методы анализа. Примеры решения задач. Учебное пособие:[Текст] / И.П. Калинкин, Т.Э. Маметнабиев - СПб.: СПбГТИ (ТУ), 2009. - 43 c.
Примеры расчетов при стандартизации раствора кислоты или щелочи
Пример 11. Какую навеску безводной соды следует взять для стандартизации
0,17 – 0,23 М раствора HCI способом пипетирования, используя пипетку и мерную колбу номинальной вместимостью  и
и 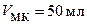 соответственно и бюретку вместимостью
соответственно и бюретку вместимостью 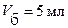 .
.
Решение. Обычно стандартизацию HCI проводят по трем навескам соды. Поскольку предполагаемый диапазон концентраций HCI велик, то первую навеску рассчитывают в предположении выданной 0,17 моль·л─1 HCI, чтобы при титровании аликвотной части (10мл) раствора  наверняка не выйти за пределы вместимости бюретки (
наверняка не выйти за пределы вместимости бюретки (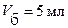 ), что недопустимо.
), что недопустимо.
Реакция титрования:
 и
и  .
.
Поскольку количества  должно хватить на 5 аликвотных частей по 10 мл
должно хватить на 5 аликвотных частей по 10 мл  , то расчетное уравнение принимает вид:
, то расчетное уравнение принимает вид:
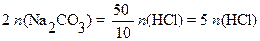 .
.
Раскрывая уравнение почленно, в соответствии с уравнениями (3') и (4'), получают следующее выражение:
 .
.
Объем титранта 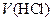 , при котором достигается минимальная относительная погрешность его измерения при работе с указанной бюреткой, составляет 4,0 – 5,0 мл. Подставляя значение
, при котором достигается минимальная относительная погрешность его измерения при работе с указанной бюреткой, составляет 4,0 – 5,0 мл. Подставляя значение  и
и  в расчетное уравнение находят
в расчетное уравнение находят  :
:  .
.
Ответ: В предположении, что 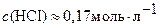 допустимая максимальная масса навески соды
допустимая максимальная масса навески соды  не должна быть больше, чем
не должна быть больше, чем  . Иначе на титрование одной аликвотной части раствора соды пойдет больше 5 мл HCI. Если фактически затраченный на титрование объем HCI окажется меньше 4 мл (в случае более концентрированной кислоты), то необходимо будет уточнить новую навеску расчетным путем, чтобы на титрование шло 4,5 – 4,8 мл HCI для получения минимальной относительной погрешности измерения
. Иначе на титрование одной аликвотной части раствора соды пойдет больше 5 мл HCI. Если фактически затраченный на титрование объем HCI окажется меньше 4 мл (в случае более концентрированной кислоты), то необходимо будет уточнить новую навеску расчетным путем, чтобы на титрование шло 4,5 – 4,8 мл HCI для получения минимальной относительной погрешности измерения  по бюретке.
по бюретке.
|
|
|
Пример 12. Какую навеску безводного 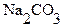 следует взять для стандартизации
следует взять для стандартизации
0,2 н. раствора H2SO4 методом пипетирования, если пользуются бюреткой вместимостью 25 мл, мерной колбой вместимостью 100 мл, и мерной пипеткой вместимостью
20 мл?
Решение. Аликвотная часть навески, отбираемая на титрование, составляет:
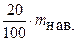 ; рабочая часть шкалы бюретки, где рекомендуется закончить титрование для получения минимальной погрешности измерения объема титранта, затраченного на титрование, находится в интервале от 3/5 шкалы до конца шкалы, т.е. в пределах от 15 до 25 мл
; рабочая часть шкалы бюретки, где рекомендуется закончить титрование для получения минимальной погрешности измерения объема титранта, затраченного на титрование, находится в интервале от 3/5 шкалы до конца шкалы, т.е. в пределах от 15 до 25 мл
 .
.
Поскольку задана нормальная концентрация кислоты, удобнее использовать эквивалентную форму записи согласно уравнениям (7') и (8 '):
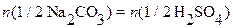 ;
;
 ;
; 
Откуда 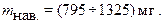
Ответ. Необходимо взять навеску соды массой ≈ 0,80 – 1,36 г.
Пример 13. (5.3 с.58 [2]). Вычислите молярную концентрацию растворов HCl и NaOH, если на титрование 0,7841г  затрачено 22,15 мл раствора
затрачено 22,15 мл раствора 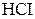 , а среднее значение объемного соотношения кислоты и щелочи составляет
, а среднее значение объемного соотношения кислоты и щелочи составляет
 . Реакция титрования:
. Реакция титрования: 

Решение. Cначала стандартизируют раствор HCl по навеске тетрабората натрия. Исходя из реакции титрования и принципа эквивалентности:

 ;
;  .
.
Затем вычисляют концентрацию раствора NaOH, пользуясь вышеприведенным значением объемного соотношения кислоты и щелочи:
 ;
; 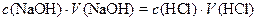
откуда: 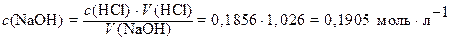
Ответ:  и
и 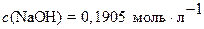
Пример 14. ( № 243 [2]. Для установления точной концентрации раствора  пипеткой отобрали 25,00 мл
пипеткой отобрали 25,00 мл  , на титрование которого затратили 23,61 мл раствора хлороводородной кислоты с титром 0,004023 г∙мл−1 . Вычислить: а) титр раствора щелочи, б) его титр по хлороводородной кислоте; в) его титр по серной кислоте.
, на титрование которого затратили 23,61 мл раствора хлороводородной кислоты с титром 0,004023 г∙мл−1 . Вычислить: а) титр раствора щелочи, б) его титр по хлороводородной кислоте; в) его титр по серной кислоте.
Решение. Для решения указанных задач пользуются формулами табл.1 или равнозначными им формулами (2.12), (2.16), (2.24), (2.25), (2.31) табл.А1 приложения А [5]:
а) 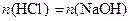 ;
;  откуда:
откуда:
 ;
;  ;
;
б) для решения задачи предварительно рассчитывают молярную концентрацию раствора  по любому из вариантов:
по любому из вариантов: 
|
|
|
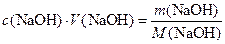 откуда:
откуда:  или:
или:
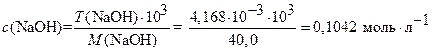 ;
;  ;
;
в) 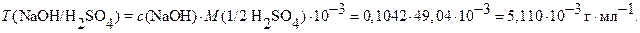 Пример 15. (5.8 с. 61[2]).Можно ли использовать способ отдельных навесок при титровании безводной соды 0,1 М раствором
Пример 15. (5.8 с. 61[2]).Можно ли использовать способ отдельных навесок при титровании безводной соды 0,1 М раствором 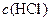 из полумикробюретки вместимостью 5 мл обеспечив при этом относительную погрешность определения не более 0,3%. Абсолютная погрешность взвешивания на аналитических весах 0,2 мг.
из полумикробюретки вместимостью 5 мл обеспечив при этом относительную погрешность определения не более 0,3%. Абсолютная погрешность взвешивания на аналитических весах 0,2 мг.
Решение.  , а масса навески
, а масса навески  :
:

Относительная погрешность взвешивания составит (0,2/26,5)∙100 = 0,75%, что превышает допустимую по условию задачи. Для уменьшения ее до допустимого значения нужно применять способ пипетирования с отношением объмов (вместимостей) мерной колбы и пипетки  , например, 50/10 или 200/20.
, например, 50/10 или 200/20.
В этом случае расчет результатов анализа проводят по уравнению:
 .
.
Относительная погрешность взвешивания в этом случае (0,2/132,5)∙100 = 0,15%, т.е. обеспечивается требование, поставленное в задаче.
Примеры расчетов при стандартизации раствора комплексона III (ЭДТА).
Пример 16. Рассчитать молярную концентрацию и титр по Mg рабочего раствора ЭДТА, если при титровании навески 0,1268 г MgSO4 его затрачено 21,06 мл.
Решение. Реакцию титрования при рН раствора 8 − 10 можно записать как:
 .
.
Соответственно количество магния и количество ЭДТА находятся в следующих стехиометрических отношениях:
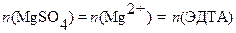 .
.
Раскрывая значения  и
и  , по уравнениям (3 ' ), (4 ') рассчитывают молярную концентрацию раствора ЭДТА:
, по уравнениям (3 ' ), (4 ') рассчитывают молярную концентрацию раствора ЭДТА:
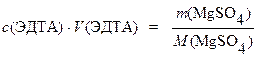
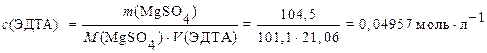 .
.
Титр  по
по  находят, например, по формуле (2.32) табл.А1 [5]:
находят, например, по формуле (2.32) табл.А1 [5]:
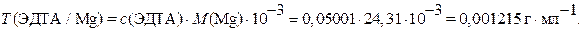
Ответ: 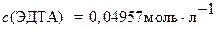 ;
;  .
.
Пример 17. Какую навеску металлического цинка (99,99%) следует взять для приготовления 100,0 мл раствора, чтобы на титрование 20,00 мл его расходовалось 20,00 мл 0,2000М раствора ЭДТА?
Решение. Реакция титрования (при рН 8 – 10):
 .
.
Аликвотная часть навески, отбираемая на титрование, составляет 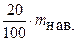 . На ее титрование потребуется количество
. На ее титрование потребуется количество  , равное:
, равное:
 .
.
Согласно условию материального баланса и уравнениям (3 ' ), (4 '):
 ;
;  .
.
Из соотношения 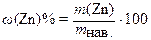 находят:
находят:

Ответ:  .
.
Пример 18. Сколько граммов металлического цинка следует растворить в кислоте, если для определения точной концентрации (стандартизации) 0,010 М раствора комплексона III (ЭДТА) способом пипетирования, используют пипетку и мерную колбу номинальной вместимостью  и
и  соответственно и бюретку вместимостью
соответственно и бюретку вместимостью  .
.
|
|
|
Решение. Реакция комплексонометрического титрования цинка при рН
раствора 8 − 10:
 .
.
Согласно условию материального баланса:  .
.
Объем титранта, при котором достигается минимальная относительная погрешность его измерения составляет  >
>  ; в данном случае
; в данном случае  . Тогда, согласно уравнениям (3 ' ), (4 '), для титрования одной аликвоты необходима навеска:
. Тогда, согласно уравнениям (3 ' ), (4 '), для титрования одной аликвоты необходима навеска:
 .
.
Общая навеска цинка с учетом 5 аликвотных частей равна:
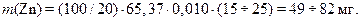
Ответ: Навеска цинка должна быть в пределах  .
.
Пример 19. Растворением навески комплексона III (ЭДТА) в 1л дистиллированной воды приготовили примерно 0,05М раствор. Стандартизация этого раствора проведена способом пипетирования с использованием мерной колбы и мерной пипетки номинальной вместимостью соответственно:  и
и  . Титрование проведено из бюретки номинальной вместимостью 25 мл. Результаты титрования четырех аликвотных объемов (
. Титрование проведено из бюретки номинальной вместимостью 25 мл. Результаты титрования четырех аликвотных объемов ( ) 0,05 М стандартного раствора
) 0,05 М стандартного раствора  составили: 19,53; 19,50; 19,52 и 19,55 мл; среднее значение
составили: 19,53; 19,50; 19,52 и 19,55 мл; среднее значение  = 19,525 мл.
= 19,525 мл.
Решение. Согласно реакции титрования при рН 8 – 10:
 .
.
В соответствии с условием материального баланса: 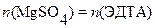 , т.е.
, т.е.

откуда:

Ответ: Точная концентрация ЭДТА, полученная в результате стандартизации, равна  .
.
Пример 20. (№357 [2]). Рассчитать для рабочего раствора ЭДТА молярную концентрацию и титр по  , если на титрование навески 0,1045 г
, если на титрование навески 0,1045 г 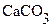 , предварительно растворенной в HCl c последующим доведением рН до 10, затрачено 21,06 мл
, предварительно растворенной в HCl c последующим доведением рН до 10, затрачено 21,06 мл
ЭДТА.
Решение. 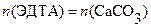
 ;
;
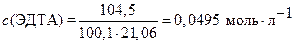 ;
;  .
.
Возможен другой вариант расчета 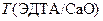 :
:
 ;
; 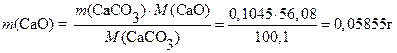 ;
;
 г∙мл−1 .
г∙мл−1 .
Ответ:  ;
;  .
.
|
|
|


