 |
Как определить степень окисления атома в ПСХЭ Д.И. Менделеева?
|
|
|
|
Валентность и степень окисления. Правила определения степеней окисления элементов
I. Валентность (повторение)
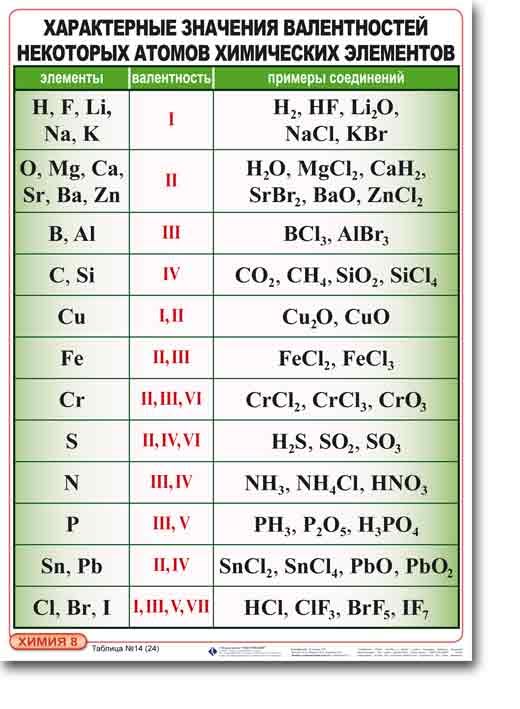
Валентность – это способность атомов присоединять к себе определенное число других атомов.
 Правила определения валентности элементов в соединениях
1. Валентность водорода принимают за I(единицу). Тогда в соответствии с формулой воды Н2О к одному атому кислорода присоединено два атома водорода.
2. Кислород в своих соединениях всегда проявляет валентность II. Поэтому углерод в соединении СО2 (углекислый газ) имеет валентность IV.
3. Высшая валентность равна номеру группы.
4. Низшая валентность равна разности между числом 8 (количество групп в таблице) и номером группы, в которой находится данный элемент, т.е. 8 - Nгруппы.
5. У металлов, находящихся в «А» подгруппах, валентность равна номеру группы.
6. У неметаллов в основном проявляются две валентности: высшая и низшая.
Например: сера имеет высшую валентность VI и низшую (8 – 6), равную II; фосфор проявляет валентности V и III.
7. Валентность может быть постоянной или переменной.
Правила определения валентности элементов в соединениях
1. Валентность водорода принимают за I(единицу). Тогда в соответствии с формулой воды Н2О к одному атому кислорода присоединено два атома водорода.
2. Кислород в своих соединениях всегда проявляет валентность II. Поэтому углерод в соединении СО2 (углекислый газ) имеет валентность IV.
3. Высшая валентность равна номеру группы.
4. Низшая валентность равна разности между числом 8 (количество групп в таблице) и номером группы, в которой находится данный элемент, т.е. 8 - Nгруппы.
5. У металлов, находящихся в «А» подгруппах, валентность равна номеру группы.
6. У неметаллов в основном проявляются две валентности: высшая и низшая.
Например: сера имеет высшую валентность VI и низшую (8 – 6), равную II; фосфор проявляет валентности V и III.
7. Валентность может быть постоянной или переменной.
 Валентность элементов необходимо знать, чтобы составлять химические формулы соединений.
Валентность элементов необходимо знать, чтобы составлять химические формулы соединений.
 Запомните!
Особенности составления химических формул соединений.
1) Низшую валентность проявляет тот элемент, который находится в таблице Д.И.Менделеева правее и выше, а высшую валентность – элемент, расположенный левее и ниже.
Например, в соединении с кислородом сера проявляет высшую валентность VI, а кислород – низшую II. Таким образом, формула оксида серы будет SO3.
В соединении кремния с углеродом первый проявляет высшую валентность IV, а второй – низшую IV. Значит, формула – SiC. Это карбид кремния, основа огнеупорных и абразивных материалов.
2) Атом металла стоит в формуле на первое место.
2) В формулах соединений атом неметалла, проявляющий низшую валентность, всегда стоит на втором месте, а название такого соединения оканчивается на «ид».
Например, СаО – оксид кальция, NaCl – хлорид натрия, PbS – сульфид свинца.
Теперь вы сами можете написать формулы любых соединений металлов с неметаллами.
3) Атом металла ставится в формуле на первое место.
II. Степень окисления (новый материал)
Степень окисления – это условный заряд, который получает атом в результате полной отдачи (принятия) электронов, исходя из условия, что все связи в соединении ионные.
Рассмотрим строение атомов фтора и натрия:
F +9)2)7
Na +11)2)8)1
- Что можно сказать о завершённости внешнего уровня атомов фтора и натрия?
- Какому атому легче принять, а какому легче отдать валентные электроны с целью завершения внешнего уровня?
- Оба атома имеют незавершённый внешний уровень?
- Атому натрия легче отдавать электроны, фтору – принять электроны до завершения внешнего уровня.
F0 + 1ē → F-1 (нейтральный атом принимает один отрицательный электрон и приобретает степень окисления «-1», превращаясь в отрицательно заряженный ион - анион)
Na0 – 1ē → Na+1 (нейтральный атом отдаёт один отрицательный электрон и приобретает степень окисления «+1», превращаясь в положительно заряженный ион - катион)
Запомните!
Особенности составления химических формул соединений.
1) Низшую валентность проявляет тот элемент, который находится в таблице Д.И.Менделеева правее и выше, а высшую валентность – элемент, расположенный левее и ниже.
Например, в соединении с кислородом сера проявляет высшую валентность VI, а кислород – низшую II. Таким образом, формула оксида серы будет SO3.
В соединении кремния с углеродом первый проявляет высшую валентность IV, а второй – низшую IV. Значит, формула – SiC. Это карбид кремния, основа огнеупорных и абразивных материалов.
2) Атом металла стоит в формуле на первое место.
2) В формулах соединений атом неметалла, проявляющий низшую валентность, всегда стоит на втором месте, а название такого соединения оканчивается на «ид».
Например, СаО – оксид кальция, NaCl – хлорид натрия, PbS – сульфид свинца.
Теперь вы сами можете написать формулы любых соединений металлов с неметаллами.
3) Атом металла ставится в формуле на первое место.
II. Степень окисления (новый материал)
Степень окисления – это условный заряд, который получает атом в результате полной отдачи (принятия) электронов, исходя из условия, что все связи в соединении ионные.
Рассмотрим строение атомов фтора и натрия:
F +9)2)7
Na +11)2)8)1
- Что можно сказать о завершённости внешнего уровня атомов фтора и натрия?
- Какому атому легче принять, а какому легче отдать валентные электроны с целью завершения внешнего уровня?
- Оба атома имеют незавершённый внешний уровень?
- Атому натрия легче отдавать электроны, фтору – принять электроны до завершения внешнего уровня.
F0 + 1ē → F-1 (нейтральный атом принимает один отрицательный электрон и приобретает степень окисления «-1», превращаясь в отрицательно заряженный ион - анион)
Na0 – 1ē → Na+1 (нейтральный атом отдаёт один отрицательный электрон и приобретает степень окисления «+1», превращаясь в положительно заряженный ион - катион)

|
Как определить степень окисления атома в ПСХЭ Д.И. Менделеева?
|
|
|
Правила определения степени окисления атома в ПСХЭ Д.И. Менделеева:
|
|
|
1. Водород обычно проявляет степень окисления (СО) +1 (исключение, соединения с металлами (гидриды) – у водорода СО равна (-1) Me+nHn-1)
2. Кислород обычно проявляет СО -2 (исключения: О+2F2, H2O2-1 – перекись водорода)
3. Металлы проявляют только +n положительную СО
4. Фтор проявляет всегда СО равную -1 (F-1)
5. Для элементов главных подгрупп:
Высшая СО (+) = номеру группы Nгруппы
Низшая СО (-) = Nгруппы–8
Правила определения степени окисления атома в соединении:
I. Степень окисления свободных атомов и атомов в молекулах простых веществ равна нулю - Na0, P40, O20
II. В сложном веществе алгебраическая сумма СО всех атомов с учётом их индексов равна нулю = 0, а в сложном ионе его заряду.
Например, H+1N+5O3-2 : (+1)*1+(+5)*1+(-2)*3 = 0
[S+6O4 -2]2-: (+6)*1+(-2)*4 = -2
Задание 1 – определите степени окисления всех атомов в формуле серной кислоты H2SO4?
1. Проставим известные степени окисления у водорода и кислорода, а СО серы примем за «х»
H+1SxO4-2
2. Составим и решим уравнение, согласно правилу (II):
(+1)*1+(х)*1+(-2)*4=0
Х=6 или (+6), следовательно, у серы CО +6, т.е. S+6
Задание 2 – определите степени окисления всех атомов в формуле фосфорной кислоты H3PO4?
1. Проставим известные степени окисления у водорода и кислорода, а СО фосфора примем за «х»
H3+1PxO4-2
2. Составим и решим уравнение, согласно правилу (II):
(+1)*3+(х)*1+(-2)*4=0
Х=5 или (+5), следовательно, у фосфора CО +5, т.е. P+5
Задание 3 – определите степени окисления всех атомов в формуле иона аммония (NH4)+?
1. Проставим известную степень окисления у водорода, а СО азота примем за «х»
(NхH4+1)+
2. Составим и решим уравнение, согласно правилу (II):
(х)*1+(+1)*4=+1
Х=-3, следовательно, у азота CО -3, т.е. N-3
|
|
|


