 |
Красноярск-Железногорск трасса 5 км, 1/1
|
|
|
|
В термохимии уравнения записывают через тепловой эффект реакции:
Pb(к) + ½О2(г) = PbО(к) + 218,3 кДж; N2(г) + O2(г) = 2NO(г) –180,4 кДж×моль–1.
Энтальпия реакции в термохимическом уравнении соответствует количеству веществ, образовавшихся или вступивших в реакцию.
Тепловой эффект реакции (кДж) образования 2 моль РbО, если термохимическое уравнение реакции: Pb(к) + ½О2(г) = PbО(к),D rН °= -218,3 кДж, составит 436,6 кДж.
Сравнение тепловых эффектов (энтальпий) химических реакций принято относить к 1 моль веществ, находящихся в стандартных условиях (ст.у.).
Стандартное состояние – это состояние чистого вещества, при температуре 298 К и давлении, равном 1 бар (101,3 кПа или 760 мм рт. ст.).
Стандартные энтальпии (теплоты) образования веществ (∆fН º), представляют собой тепловой эффект образования 1 моль сложного вещества из простых веществ, находящихся в стандартных состояниях.
ИЮПАК рекомендовано их обозначение верхним индексом º, а нижним индексом – вид превращения или процесс.
Реакция реагенты®продукты ∆ rH º
Образование простые вещества®соединение ∆ fH º
(f – от англ. formation)
Энтальпии образования простых веществ, устойчивых в стандартных состояниях (графит, ромбическая сера, жидкий бром, кристаллический йод и т.д.), принимают равными нулю.
Тепловой эффект реакции можно рассчитать по массе (объему, количеству вещества) исходных веществ или продуктов реакции.
Задача. Определите стандартную энтальпию образования (кДж×моль–1) Al2O3, если при взаимодействии 9 г Al с кислородом выделяется 279,7 кДж.
Решение:
1. Термохимическое уравнение реакции:
 D fH o =?
D fH o =?
показывает, что на образование 1 моль Al2O3 расходуется 2 моль Al.
2. Количество Al, соответствующее 9 г алюминия:
|
|
|
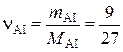 , моль,
, моль,
где М (Al) = 27 г/моль.
3. Рассчитаем стандартную энтальпию образования 1 моль Al2O3:
9/27 мольAl выделяет 279,7 кДж
2 моль Al– х, кДж, Откуда: х = 1678,2 кДж.
4. Полученная величина является тепловым эффектом реакции. Стандартная энтальпия образования Al2O3 противоположна по знаку этой величине. Ответ: -1678,2.
Основой термохимических расчетов служит закон Гесса (1840 г.): тепловой эффект реакции зависит лишь от природы и физического состояния реагентов и продуктов реакции и не зависит от пути ее протекания.
Например, реакция окисления графита кислородом до СО2 может протекать через две стадии:
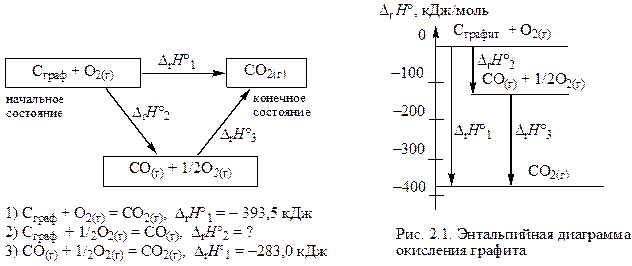
Графическое изображение энергетической диаграммы процесса (рис. 2.1) показывает, что суммарный тепловой эффект равен сумме тепловых эффектов отдельных стадий:
D rН °1 = D rН °2 + D rН °3.
Обычно энтальпию образования СО (D rН °2) измерить невозможно, так как при горении угля в условиях недостатка кислорода образуется СО и СО2, но можно рассчитать по известным значениям D rН °1 и D rН °3.
Для получения уравнения (2) необходимо из уравнения (1) вычесть уравнение (3):
С(графит) + О2(г) = СО(г) –1/2 О2(г),
или С(графит) +1/2О2(г) = СО(г),
что соответствует D rН °2 = D rН °1 – D rН °3 = –393,5 – (–283) = –110,5 кДж.
Следствие закона Гесса:
1) для обратимых реакций энтальпия прямой реакции равна энтальпии обратной реакции, взятой с противоположным знаком, например:
СаСО3(к) = СаО(к) + СО2(г), D rН ° = + 178 кДж×моль–1
СаО(к) + СО2(г) = СаСО3(к), D rН ° = – 178 кДж×моль–1
2) тепловой эффект реакции равен разности сумм энтальпий образования продуктов реакции и сумм энтальпий образования реагентов с учетом стехиометрических коэффициентов (i, j) в уравнении реакции:
∆ rH º = ∑ i ∆ fH º продукты реакции –∑ j ∆ fH ºреагенты (3)
Например: Можно рассчитать тепловой эффект реакции промышленного способа получения вольфрама WO3(к) + 3H2(г) = W(к) + 3H2O(г) при стандартных условиях.
|
|
|
Решение:
1. Воспользуемся табличными значениями стандартных энтальпий образования веществ:
WO3(к) + 3H2(г) = W(к) + 3H2O(г)
D fH ºкДж/моль –842,7 0 0 – 241,8
2. Рассчитаем изменение энтальпии реакции (3):
D rH º298 = [D fH º(W(к)) + 3×D fH º(H2O)(г)] –[D fH º(WO3)(к) + 3×D fH º(H2)(г)] =
= – 241,8 – (– 842,7) = 600,9 кДж×моль–1.
Ответ: 601 кДж
Второй закон термодинамики и энтропия определяют, какие из процессов будут происходить самопроизвольно. Энтропия − термодинамическая функция состояния (S), которая является мерой неупорядоченности любой равновесной термодинамической системы.
Самопроизвольно в изолированной системе протекают процессы,характеризующиеся увеличением энтропии, DS>0.
По Р.Клаузиусу энтропия имеет размерность энергии, деленной на температуру (D S = D Q / T), т.е. размерность энтропии Дж/моль×К.
Третий закон термодинамики « при абсолютном нуле энтропия идеального кристалла равна нулю» позволяет определить абсолютное значение энтропии веществ и ее изменение в химической реакции:
D rS o = S iS oпродукты реакции – S jS oреагенты , (4)
где S o –энтропия одного моля вещества в его стандартном состоянии,
Энергия Гиббса (изобарно-изотермический потенциал) объединяет два фактора (энергетический D rН oи энтропийный Т× D rS o) в оценке возможности совершения процесса уравнением:
D rG o= D rН o– Т× D rS o. (5)
Изменение стандартной энергии Гиббса в системе в ходе протекания химической реакции определяется аналогично D rН o и D rS o:
D rG o= S i D fG oпродукты реакции – S j D fG oреагенты, (6)
где D fG o – стандартная энергия Гиббса образования 1 моль соединения из соответствующих простых веществ, находящихся в стандартных состояниях (кДж/моль). При этом D fG o образования простого вещества в их стандартных состояниях равна нулю.
1. Все самопроизвольные химические превращения идут в направлении уменьшения энергии Гиббса D rG o< 0.
2. Самопроизвольно протекают процессы в обратном направлении, для которых D rG o> 0.
3. Система находится в состоянии равновесия, если D rG o = 0.
Задача 3. Определите термодинамическую возможность самопроизвольного протекания процесса восстановления диоксида титана до свободного металла и оксида углерода (II) при 298 и 2500 К. Какова температура, при которой может протекать процесс? Зависимостью ∆ rН oи ∆ rS o от температуры пренебречь.
|
|
|
Решение:
1. Напишем уравнение процесса, выпишем значения термодинамических функций для веществ реакции:
TiO2(к) + 2С(графит) = Ti(к.) + 2СО(г) ∆ rН o298 =?
–888,6 –137, 1 D fG o298,кДж×моль–1
–943,9 –110,5 ∆ fН o298,кДж×моль–1
50,3 5,7 30,6 197,5 S o298,Дж×моль–1×К–1.
2. Тогда, согласно следствия закона Гесса, для реакции:
D rG o298= – 137,1×2 – (–888,6) = 614,4 кДж×моль–1.
Так как D rG o298> 0 восстановление TiO2(к) углеродом при 298 К термодинамически невозможно.
3. Для расчета D rG o2500 по уравнению 2.6 необходимо рассчитать изменение энтальпии и энтропии реакции при стандартных условиях:
∆ rН o298 = 2×Δ fH °(CO(г)) – Δ fH o(TiO2(к)) = 2 (–110,5) – (– 943,9) = 722,9 кДж.
∆ rS o298 = [ S o (Ti(к.))+ 2× S °(СО (г))] – [ S o(TiO2(к)) + 2× S o(С(графит))] =
= 30,6 + 2×197,5 – 50,3 – 2×5,7 = 425,6 – 61,7 = 363,9 Дж×моль–1×К–1 = 0,363 кДж×моль–1×К–1.
Энергия Гиббса реакции при 2500 К:
D fG о2500 = 722,9 - 2500×(363,9/1000) = 722,9 - 909,8 = -186,9 кДж.
Температура, при которой меняется знак энергии Гиббса:
Т = ∆ rН o/∆ rS o = 722,9 0,3639 = 1986,5 К.
Ответ: Принципиально возможно протекание реакции в прямом направлении при 2500 К (D fG о2500< 0) и принципиально невозможно при температурах < 1986,5 К.
Лекция 2. Химическая кинетика
Реакционная способность вещества проявляется в скорости его химического превращения, т.е. в изменении его количества во время реакции.
Скорость гомогенной реакции (реагирующие вещества находятся
в одной фазе) определяют как изменение концентрации одного из реагирующих веществ во времени:
 , моль/л·с (7)
, моль/л·с (7)
где V – средняя скорость реакции за данный промежуток времени Dt.
Закон действующих масс (ЗДМ) определяет зависимость концентрации реагентов от скорости химического взаимодействия (основной закон химической кинетики): скорость химических реакций, протекающих
в однородной среде, пропорциональна произведению концентрации реагирующих веществ.
Математически это положение для простой реакции:
|
|
|
аА + bB = dD
можно выразить следующим образом:
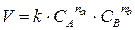 , (8)
, (8)
где СА, СВ – молярные концентрации веществ А и В, моль/л; k – коэффициент пропорциональности, называемый константа скорости химической реакции; nа, nb – показатели порядка реакции по веществу А и В, соответственно. Общий порядок реакции равен сумме порядков реакции по веществам: n = nа + nb. Он определяется экспериментально.
Кинетическое уравнение простой реакции: 2NO(г)+ Cl2(г)= 2NOCl(г) будет иметь вид  .
.
Константа скорости химической реакции зависит только от природы реагирующих веществ и температуры. Физический смысл константы – она равна скорости реакции, при концентрации реагирующих веществ равных 1 моль/л.
Для газообразных веществ концентрация прямопропорциональна давлению. Тогда этот закон можно применить для предсказания как изменится скорость реакции с изменением давления в ней.
Например: Скорость реакции 2SO2(г) + O2(г) = 2SO3(г) при уменьшении объема газовой смеси в 2 раза, если порядок по веществу SO2 равен 2, по кислороду 1 увеличится в 8 раз.
Скорость гетерогенной реакции зависит от величины поверхности твердой фазы. Изучение этих реакций часто проводят в условиях постоянства их поверхности, которая не учитывается в законе действующих масс.
Например: Скорость реакции С(графит) + О2(г) = СО2(г), при увеличении давления в 4 раза увеличится в 4 раза. Так как С(графит) –твердое вещество, концентрацию которого принимаем за единицу. Выражение ЗДМ для реакции имеет вид: 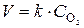 . Изменение давления равносильно изменению концентрации газообразных веществ:
. Изменение давления равносильно изменению концентрации газообразных веществ: 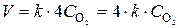 , т. е. скорость реакции возрастет в 4 раза.
, т. е. скорость реакции возрастет в 4 раза.
Правило Вант-Гоффа определяет влияние температуры на скорость реакции: повышение температуры на каждые 10°С увеличивает скорость реакции в 2÷4 раза, т.е.
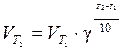 , (9)
, (9)
где 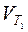 и
и 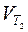 – скорость реакции, соответственно, при температурах T 1 и T 2; g– температурный коэффициент, равный для большинства реакций 2 ¸4.
– скорость реакции, соответственно, при температурах T 1 и T 2; g– температурный коэффициент, равный для большинства реакций 2 ¸4.
Например: Две реакции протекают при 20оС с одинаковой скоростью. Температурный коэффициент скорости первой реакции равен 2,0, а второй – 4,0. Отношение скоростей этих реакций при 70оС составит_____.
Решение:
1. Пусть скорости этих реакций при 20оС равны соответственно V 20
и V 201; по условию задачи V 20 = V 201.
2. Изменение температуры D T = T 2 – T 1 =70 – 20 = 50oС.
3. Скорости реакций при 70оС:
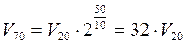 и
и  .
.
4. Отношение скоростей второй реакции к скорости первой реакции составляет:
 .
.
Ответ: 32.
Более точно зависимость скорости реакции от температуры описывает уравнение Аррениуса:
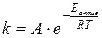 , (10)
, (10)
где k – константа скорости реакции; А – предэкспоненциальный множитель, учитывающий число столкновений молекул в единицу времени; е – основание натурального логарифма; R – универсальная газовая постоянная, равная 8,31 Дж/(моль∙К); Т – абсолютная температура (К); Е – энергия активации, т.е. энергия, которую необходимо сообщить молю вещества для перевода молекул в активное состояние, кДж/моль.
|
|
|
Например: Если константа скорости некоторой реакции при 20°С равна 2×10−2, а при 40°С 3,6×10−1, то энергия активации реакции составит ______кал.
Решение:
1.Преобразуем уравнение Аррениуса (10):
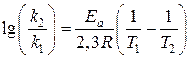 (11)
(11)
2. Выразим температуру в абсолютной шкале и подставим данные
в формулу:

или
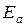
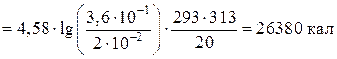
Ответ: 26380.
3. Химическое равновесие
Реакции, которые протекают в одном направлении и протекают до конца, называют необратимыми. Большинство реакций являются обратимыми, т.е. протекают в противоположных направлениях и не идут до конца.
Состояние системы, когда скорости прямой и обратной реакции равны между собой,называют химическим равновесием. Оно характеризуется константой химического равновесия.
Для обратимой реакции, записанной в общем виде: аА + bB ⇄ сC + dD
в соответствии с законом действующих масс имеем:
 , (12)
, (12)
где 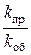 – обозначается К и называется константой химического равновесия [ A ], [ B ], [ C ], [ D ] – равновесные концентрации веществ, моль/л.
– обозначается К и называется константой химического равновесия [ A ], [ B ], [ C ], [ D ] – равновесные концентрации веществ, моль/л.
Константа равновесия зависит только от природы реагирующих веществ и температуры, но не зависит от их концентраций. Она показывает,
во сколько раз скорость прямой реакции больше скорости обратной реакции при концентрации исходных веществ, равных единице (физический смысл).
Задача 4. Для процесса 2SO2 + O2⇄ 2SO3, протекающего при постоянной температуре, известны равновесные концентрации газов (в моль/л): [SO2]= 0,04; [O2]= 0,06; [SO3]= 0,02. Найти константу равновесия и начальные концентрации SO2 и O2.
Решение:
1. Подставим численные значения равновесных концентраций веществ в выражение константы равновесия:
 .
.
2. Выразим начальные концентрации (С) веществ через равновесные. Пусть х –число молей O2, израсходованное в реакции. Тогда [O2]= 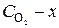 .
.
По уравнению 1 моль O2 взаимодействует с 2 молями SO2, и равновесная 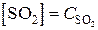 – 2 х. При взаимодействии 1 моля O2 образуется 2 моля SO3,
– 2 х. При взаимодействии 1 моля O2 образуется 2 моля SO3,
х молей O2 дают 2 х молей SO3, т.е. [SO3]= 2 х.
3. По условию задачи [SO3]= 0,02. Поэтому х = 0,01 моль/л. Следовательно,
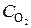 = [O2] + 0,01 = 0,06 + 0,01 = 0,07 моль/л;
= [O2] + 0,01 = 0,06 + 0,01 = 0,07 моль/л;
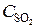 = [SO2] + 2 х = 0,04 + 2×0,01 = 0,06 моль/л.
= [SO2] + 2 х = 0,04 + 2×0,01 = 0,06 моль/л.
Ответ: К = 4,16. 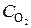 = 0,07 моль/л;
= 0,07 моль/л; 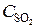 = 0,06 моль/л.
= 0,06 моль/л.
Константа равновесия может быть рассчитана из изотермы Вант-Гоффа при Δ rG° = 0, являющимся термодинамическим условием химического равновесия, если известно стандартное значение энергии Гиббса:
Δ rG°= –RT ×ln K = – 2,3 R T ×lg K
или (13)
Δ rG°= – 5,69×lg K.
Смещение химического равновесия определяется правилом Ле-Шателье: если на систему, находящуюся в равновесии, производится какое-либо воздействие (изменение С, t, р), то равновесие сместится в сторону того процесса, который ослабляет произведенное воздействие.
1. Увеличение концентрации исходных веществ и удаление продуктов из сферы реакции смещает равновесие реакции в сторону прямой реакции (вправо).
2. Повышение температуры сдвигает равновесие реакции в сторону поглощения тепла (эндо термической реакции Δ rН°> 0), понижение температуры в сторону – выделения тепла (экзо термической Δ rН°< 0).
3. Увеличение давления смещает равновесие реакции в сторону меньшего числа молей газообразных веществ, уменьшение давления – в сторону большего числа молей газообразных веществ.
Пример. Определите направление смещения равновесия реакции
N2(г) +3H2(г) ⇄ 2NH3(г),Δ rН°= –92 кДж×моль–1
при увеличении температуры и концентрации аммиака, уменьшении давления.
Решение:
1. Уравнение реакции показывает, что прямая реакция экзотермична, а обратная − эндотермична. Увеличение температуры смещает равновесие в сторону эндотермической реакции, для которой (Δ rН° > 0), т.е. в сторону исходных веществ, влево.
2. Для определения влияния давления необходимо подсчитать объем газообразных веществ в обеих частях уравнения:
N2(г) + 3H2(г) ⇄ 2NH3(г).
1 моль + 3 моль = 2 моль.
Понижение давления сдвигает равновесие в сторону большего числа молей веществ, т. е. влево, так как число молей левой части уравнения (4) больше числа молей правой части (2).
3. Повышение концентрации продуктов реакции (NH3) сдвигает равновесие реакции в сторону исходных веществ, в сторону уменьшения С(NH3), т.е. влево.
|
|
|


