 |
Симметрия атомов и кристаллов
|
|
|
|
Материаловедение
- История развития
- Источники науки о материалах
- Содержание и задачи
Структура чистых материалов
- Электронная структура и периодическая система элементов
- Силы связи и основные типы твёрдых тел
- Кристаллическая структура
- Несовершенства в кристаллах
Диффузия
- Механизмы диффузии и самодиффузии
- Факторы влияния
- Коэффициенты диффузии и самодиффузии
- Макроскопическая диффузия. Закон Фика
Структура чистых материалов
Электронная структура и периодическая система элементов
Периодическая система элементов по Менделееву
- ряд с возрастанием атомного веса
- повторяемость химических свойств, валентности
- нарушение системы (Со-Ni, Ar-K, Te-J)
- разработана для 63 известных тогда элементов
- предсказаны ещё 10
Модели атома до квантовой механики
- исходные данные по поведению в электрических и магнитных полях, химическим свойствам и излучению света (линейчатый спектр), по наличию разноимённых зарядов
- модель Томсона – попытка объяснить оптические свойства на основе осциллятора с основной частотой 
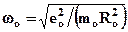 и гармониками
и гармониками
- модель Резерфорда с небольшим по размеру и тяжёлым ядром и лёгкими электронам (планетарность, определение Z, ограниченная область действия кулоновских сил)
- модель Бора (постулаты стационарных квантованных состояний и частот n = (Еn1-En2)/h, трудности с объяснением интенсивности излучения, неприменимость к многоэлектронным системам – только водород и ионизированный гелий)
Квантовая механика и квантовые числа
- дуализм квантовой механики, волновая функция, вероятность события, квантование энергии, принцип Паули
- квантовые числа
|
|
|
главное n = 1(К), 2 (L), 3 (M), 4 (N), 5 (O), 6 (P), 7 (Q)
орбитальное l = 0 (s),1(p), 2 (d), 3 (f), 4 (g),…,n-1
магнитное m = 0, ±1, ±2,…, ± l
спиновое ms = ±1/2 (проекция спина на ось z)
Отсюда Ns =2, Np= 6, Nd = 10, Nf = 14.
- порядок заполнения орбиталей
Последовательно начиная с меньшего n
снятие вырождения l - уровней у многоэлект-ронных атомов:
а) в порядке возрастания l на внешней орбитали
Б) 4s ниже 3d, 5s ниже 4d, 6s ниже 5d и 4f, 7s ниже 6d и 5f
В) внешние орбитали содержат только элект-роны s - и p – подорбиталей, которые определяют валентность
| № орби-тали | Электронная структура | Максимальное число электронов |
| 1s | ||
| 2s 2p | ||
| 3s 3p | ||
| 4s 4p | ||
| 5s 5p | ||
| 6s 6p | ||
| 7s 7p |
Электронное строение элементов
| Пе-ри-од | Эле-менты | Z | K | L | M | N | O | P | Q | |||||||||||
| 1s | 2s | 2p | 3s | 3p | 3d | 4s | 4p | 4d | 4f | 5s | 5p | 5d | 5f | 6s | 6p | 6d | 7s | |||
| H®He | 1®2 | 1®2 | ||||||||||||||||||
| Li®Be B®Ne | 3®4 5®10 | 1®2 | 1®6 | |||||||||||||||||
| Na®Mg Al®Ar | 11®12 13®18 | 1®2 | 1®6 | |||||||||||||||||
| K®Ca Sc®Ni Cu®Zn Ga®Rr | 19®20 21®28 29®30 31®36 | - 1®10 | 1®2 0,1,2 1®2 | 1®6 | ||||||||||||||||
| Rb®Sr Y®Pd Ag®Cd In®Xe | 37®38 39®46 47®48 49®54 | - 1®10 | - - - - | 1®2 0,1,2 1®2 | 1®6 | |||||||||||||||
| Cs®Ba La Ce®Lu Hf®Pt Au®Hg Tl®Rn | 55®56 58®71 72®78 79®80 81®86 | - - 1®14 | - 0,1 1®10 | - - - - - - | 1®2 0,1,2 1®2 | 1®6 | ||||||||||||||
| Fr®Ra Ac Th®Lw | 87®88 90®103 | - - 1®14 | - 1,2 | 1®2 |
Периодическая система элементов
IA 0
| 1 H 1.0080 | IIA | IIIB | IVB | VB | VIB | VIIB | 2 He 4.003 | ||||||||||||
| 3 Li 6.940 | 4 Be 9.013 | IIIA IVA VA VIA VIIA VIII IB IIB | 5 B 10.81 | 6 C 12.011 2,4 | 7 N 14.007 | 8 O 16.000 | 9 F 19.00 | 10 Ne 20.182 | |||||||||||
 11 Na
22.990 11 Na
22.990
| 12Mg 24.32 | 13 Al 26.98 | 14 Si 28.09 | 15 P 30.97 3,5 | 16 S 32.066 2,4,6 | 17 Cl 35.453 1,3,5 | 18 Ar 39.946 | ||||||||||||
| 19 K 39.100 | 20 Ca 40.08 | 21 Sc 44.96 | 22 Ti 47.90 2,3,4 | 23 V 50.95 | 24 Cr 52.01 3,6 | 25Mn 54.94 2-4,6,7 | 26 Fe 55.85 2,3 | 27 Co 58.94 2,3 | 28 Ni 58.71 | 29 Cu 63.54 1,2 | 30 Zn 65.38 | 31 Ga 69.72 3,1,2 | 32 Ge 72.59 4,2 | 33 As 74.91 3,5 | 34 Se 78.96 2,4,6 | 35 Br 79.91 | 36 Kr 83.80 | ||
| 37 Rb 85.48 | 38 Sr 87.62 | 39 Y 88.92 | 40 Zr 91.22 4,2,3 | 41 Nb 92.91 | 42Mo 95.95 | 43 Tc | 44 Ru 101.1 6,4,8 | 45 Rh 102.91 3,4 | 46 Pd 106.4 2,4 | 47 Ag 107.87 | 48 Cd 112.40 | 49 In 114.82 3,1,2 | 50 Sn 118.69 4,2 | 51 Sb 121.74 3,5 | 52 Te 127.61 2,4,6 | 53 I 126.91 | 54 Xe 131.3 | ||
| 55 Cs 132.91 | 56 Ba 137.36 | 57 La 138.92 | 72 Hf 178.6 | 73 TA 180.95 | 74 W 183.85 | 75 Re 186.22 6,7 | 76 Os 190.2 6,4,8 | 77 Ir 192.2 3,4 | 78 Pt 195.09 2,4 | 79 Au 197.0 1,3 | 80 Hg 200.6 2,1 | 81 Tl 204.37 1,3 | 82 Pb 207.2 2,4 | 83 Bi 209.0 3,5 | 84 Po | 85 At | 86 Rn | ||
| 87 Fr | 88 Ra 226.05 | 89 Ac | |||||||||||||||||
| 58 Ce 140,13 3,4 | 59 Pr 140.92 3,4 | 60Nd 144.24 | 61Pm | 62Sm 150.35 2,3 | 63Eu 152.0 2,3 | 64Gd 157.25 | 65Tb 158.92 3,4 | 66Dy 162.50 | 67Ho 164.93 | 68Er 167.3 | 69Tu | 70Yb 173.04 2,3 | 71Lu 174.98 |
| 90 Th 232.05 | 91Pa 231.1 | 92 U 238.07 4,5,6 | 93Np | 94 Pu | 95Am | 96Cm | 97Bk | 98 Cf | 99 Es | Fm | Mv | (NO) | Lw |
Классификация элементов
|
|
|
- химически инертные (благородные газы) – общее число - 6
- химически активные
А) металлы – все элементы А-подгруппы (расположенные левее меди, серебра, золота)
– левый угол В-подгруппы (левее диагонали бор –йод)
– общее число - 82
Б) металлоиды – правый угол В-подгруппы, наиболее типичны – фтор, кислород,хлор
– общее число - 8
В) промежуточные – вблизи от диагонали (полу-проводники Si, Ge, Se, Te, а также H, B, C)
– общее число 7
Силы связи между атомами
Действующие силы
- гравитационные 
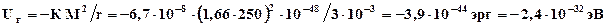
- магнитные
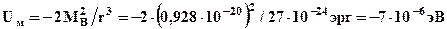
- электростатические
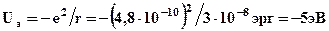
 - действие сил притяжения и отталкивания
- действие сил притяжения и отталкивания
Основные типы связи
Электроотрицательность Uэ = 0,5 (Ui + Uc)
Металлы IA – 0,8-1,0 эВ
IIA – 1,2-1,5 эВ
Металлоиды VIB – 2,0-3,1 эВ
VI1B – 2,4-3,5 эВ
VIIIB – 2,5-4,0 эВ
| Элементы | Полярность | Тип связи |
| Металлоид-металлоид | гомополярная | ковалентная |
| Металл-металл | гомополярная | металлическая |
| Металл-металлоид | гетерополярная | ионная |
| Инертные и двухатом-ные газы в твёрдом состоянии | гетерополярная | типа Ван-дер-Вальса |
Ионная связь
|
|
|
- Результат притяжения разноимённых ионов, ограниченного принципом Паули
- Энергия ионной связи u = -Ae2/d + Bexp(d/r)
или u = -Ae2/d + Bd-10,
(d – расстояние между ионами, r - характеристика сжимаемости)
u = 6 - 10 эВ (для NaCl u = 8 эВ)
- Высокие Tm, прочность, твёрдость, низкий коэффициент температурного расширения.
- Изоляторы в твёрдом состоянии.
Ковалентная
- Результат объединения электронов разных атомов с разным спином (обменное взаимодействие) в направлении получения стабильного (ns + np) - октета.
- Эффект резонанса (частичная принадлежность пары электронов двум атомам без связи с ними)
- Число единичных связей – до 8-N (кроме элементов I-III групп)
- Пространственная направленность связей
- Энергия связи от 1,6 эВ (Ge-Ge) до 7,3 эВ в алмазе.
- Высокие Tm, прочность, твёрдость.
- Изоляторы в любом состоянии.
Типа Ван-дер-Вальса
- Взаимная поляризация электронов соседних атомов.
- Присуща всем элементам, но играет роль при отсутствии иных связей.
- Слабая связь. Энергия связи порядка 0,01 эВ.
- Нет поляризации, плотная упаковка атомов.
- Изоляторы в любом состоянии.
Металлическая
- Обобщение и свобода перемещения валентных электронов в кристалле
- Энергия связи u = Ae2/W 1/3 + B/W 2/3 + Ce2/W,
(А, В и С – константы, W - атомный объём). Энергия u в кристаллах значительно меньше, чем у двухатомной молекулы, и может составлять десятые доли эВ на связь.
- Связь ненасыщенная, гетерополярная. Сверхплот-ные и плотные упаковки.
- Высокая электро- и теплопроводность, пластич-ность.
Кристаллическая структура
Симметрия атомов и кристаллов
- Облака у s – орбиталей сферично, у p – орбиталей вытянуты в трёх взаимно перпендикулярных направлениях.
- В твёрдом теле геометрия электронных облаков определяется и характером, числом связей.
- Элементы симметрии – трансляция, поворот, отражение, инверсия.
- Примитивная и элементарная ячейки.
|
|
|


