 |
Тепловой эффект химической реакции равен сумме теплот (энтальпий) образования продуктов реакции за вычетом суммы теплот (энтальпий) образования исходных веществ
|
|
|
|
ВВедение
Химия изучает химическую форму движения материи, под которой понимают превращение одних веществ в другие. В результате химических процессов появляются новые вещества с новыми физическими и химическими свойствами. Химические превращения называются химическими реакциями.
Изучение характера протекания и динамики реакций является основной задачей химии, поскольку успешное ее решение позволяет предсказать и описать химический процесс, а также найти оптимальные условия его проведения. Все это необходимо для получения новых химических веществ, используемых в научных и практических целях. Это позволяет развивать и углублять основные представления химии как науки, а также целенаправленно использовать возможности химии для удовлетворения потребностей общества.
При изучении химических реакций используется ряд последовательных приближений.
Можно, сначала, изучать только начальное и конечное состояния системы (т.е. исходных веществ и продуктов реакции), не вдаваясь в тонкости происходящего. В этом заключается подход химической термодинамики.
В таком случае изучаются только наиболее общие закономерности протекания химических процессов. Такой подход не позволит узнать о химическом превращении самые тончайшие подробности, однако сможет ответить на важные, часто принципиальные, вопросы: возможно ли в принципе данное превращение и каковы его энергетические характеристики.
Именно рассмотрению указанных вопросов и посвящено пособие.
1. основные понятия
химической термодинамики
Прежде чем приступить к изучению предмета химической термодинамики, необходимо ввести ряд терминов и понятий, используемых в этом разделе.
|
|
|
Изучаемые химической термодинамикой объекты принято объединять понятием системы. Система - это совокупность изучаемых в данной задаче объектов, мысленно или физически отделенных от остального пространства. По своим взаимоотношениям с окружающим миром системы принято подразделять на открытые, закрытые и изолированные.
Открытыми называются системы, способные обмениваться с окружающим пространством, как веществом (иногда используют термин «масса»), так и энергией. Примером такой системы может служить открытый реакционный сосуд (колба, лабораторный стакан, пробирка и т.д.). Его можно охладить или нагреть, можно добавить в него какие-либо вещества или отобрать часть веществ оттуда. В процессе химического превращения определенная часть веществ может самопроизвольно покидать такую систему, например, испаряться.
Закрытыми называются системы, которые могут обмениваться с окружающим пространством только энергией, но не веществом. Примером такой системы может быть закрытый реакционный сосуд (реторта, химический реактор и т.д.). Нагревание, охлаждение, облучение светом такой системы возможно, изменение массы – нет.
Изолированными называются системы, неспособные обмениваться с окружающей средой ни массами, ни энергией. Абсолютно изолированных систем в природе, конечно, не бывает, но условия близкие к ним можно создать, например, в термосе или сосуде Дьюара.
Системы подразделяют также по фазовому составу. Определим сначала само понятие фазы.
Фаза - совокупность всех однородных частей системы, обладающих одинаковым составом и одинаковыми свойствами, отделенная от остальных частей системы поверхностью раздела.
Однофазиую систему называют гомогенной, многофазную систему – гетерогенной. Примером однофазной системы может служить воздух, несмотря на то, что он состоит из нескольких газообразных веществ. Однофазной системой является также водный раствор какого-либо вещества – в нем отсутствуют границы раздела фаз. Вода вместе с плавающим в ней льдом, напротив, является двухфазной системой, хотя обе фазы имеют одну химическую природу. Система останется двухфазной, даже если в воде будет плавать несколько кусочков льда: все они имеют одинаковый состав и свойства.
|
|
|
FПриведите самостоятельно примеры различных термодинамических систем.
Любая термодинамическая система характеризуется совокупностью так называемых термодинамических параметров.
Здесь надо пояснить, как описывает термодинамика все происходящие в системе явления. Термодинамические системы состоят обычно из очень большого числа частиц, находящихся к тому же в постоянном тепловом движении.
Описать происходящее в такой системе методами классической механики невозможно даже для самой простой ситуации. Вспомните, что один моль любого вещества состоит из 6,02·1023 молекул. Решить для каждой частицы уравнение движения (уравнения Ньютона), чтобы точно знать координаты и скорости каждой молекулы в любой момент времени, не под силу не только человеку, но и самому мощному компьютеру. Поэтому приходится удовлетвориться описанием системы с помощью тех величин, которые характеризуют ее состояние в целом, дают усредненную картину происходящего. Такой подход к решению задачи называется статистическим. Величины, описывающие состояние системы в целом, называются термодинамическими параметрами. Наиболее важными из них являются температура (t°), давление (р), объем (V), количество вещества (ν), концентрация вещества (С) и т.п.
F Вспомните из школьного курса физический смысл этих величин.
Те параметры, значение которых не зависит от количества вещества, называются интенсивными, ате, значение которых зависит от количества вещества - экстенсивными. К первому типу относятся, например, температура и давление, ко второму - объем.
Изменение одного из параметров ведет, как правило, к изменению состояния системы и, следовательно, других параметров. Состояние системы аналитически, т.е. в виде математического выражения, можно представить так называемым уравнением состояния, связывающим между собой все параметры системы. В общем виде уравнение состояния выглядит следующим образом:
|
|
|
f(p,V,Т,ν,...) = 0
Уравнения состояния позволяют проследить, как меняются параметры системы на всем пути ее перехода из одного состояния в другое. Конкретный вид уравнения состояния известен только для некоторых очень простых систем, например, уравнение Менделеева-Клапейрона, описывающее состояние идеального газа: pV = (m/M)RT
К сожалению, для большинства реальных систем подобные простые уравнения записать невозможно. Это приводит к необходимости введения понятия функций состояния. Эти величины также определяются через параметры состояния. Для каждого конкретного случая эти функции будут иметь свой вид, связывая термодинамические параметры в математические выражения. Они могут быть простыми или сложными, в зависимости от свойств данной системы и условий ее существования. Самая важная особенность функций состояния – изменение таких функций не зависит от пути, по которому система перешла из одного состояния в другое, а зависит только от начального и конечного состояний изучаемой системы. В термодинамике известно большое количество величин, обладающих свойствами функций состояния, но ниже будут рассмотрены только самые важные из них.
Фундаментальной функцией состояния является полная энергия системы Е, которая представляет собой сумму трех составляющих - кинетической энергии Екин. движущейся системы, потенциальной энергии Епот., связанной с воздействием на систему внешних сил (гравитационных, электростатических или иных) и внутренней энергии системы U:
Е = Екин.+ Епот.+U (1)
В термодинамике предполагают, что система находится в состоянии относительною покоя, а воздействие внешних сил пренебрежимо мало. Тогда полная энергия системы равна ее внутренней энергии. Точное значение внутренней энергии определить невозможно, потому что она складывается из большого числа различных взаимодействий, природа и величина которых до конца не изучена. Внутреннюю энергию системы определяют кинетическая и потенциальная энергия молекул, энергия взаимодействия атомов в молекулах, энергия взаимодействия электронов и протонов в атомах, из которых состоят молекулы, энергия взаимодействия частиц, составляющих атомное ядро и т.д. К счастью, для решения вопросов термодинамики абсолютное значение внутренней энергии знать не обязательно. Вполне достаточно определить только изменение внутренней энергии ΔU, происходящее при переходе системы из одного состояния в другое. Эти изменения происходят в соответствии с законом сохранения энергии, который для термодинамических систем формулируется, как первое начало термодинамики:
|
|
|
Q = ΔU + A (2)
Сообщенная системе теплота (Q) расходуется на приращение внутренней энергии (ΔU) и на совершение системой работы (А) против внешних сил. То есть, общий запас внутренней энергии остается постоянным, если отсутствует тепловой обмен с окружающей средой. В ходе процессов, протекающих в изолированной системе, возможно лишь перераспределение внутренней энергии между отдельными составляющими системы.
Теплота является мерой энергии, передаваемой от одного тела к другому за счет разницы температур этих тел. Эта форма энергии связана с хаотическим столкновением частиц соприкасающихся тел. При столкновениях частиц происходит передача энергии от более нагретого тела к менее нагретому. Переноса вещества при этом не происходит.
Работа является мерой энергии, передаваемой от одного тела к другому за счет перемещения частиц (тел) под действием каких-либо сил.
Теплота и работа измеряются в единицах энергии (джоуль, калория, эрг и т.п.).
Важно, что обе величины не являются функциями состояния и зависят от способа передачи энергии (пути перехода системы из одного состояния в другое).
Рассмотрим два, наиболее часто встречающихся, случая изменения состояния системы:
а) процесс может протекать при постоянном объеме (V = сonst);
б) процесс может протекать при постоянном давлении (р = сonst).
Первый случай. Если не происходит изменения объема, то не совершается и работа системы против внешних сил, так как отсутствуют какие-либо перемещения. Следовательно, математическое выражение первого начала термодинамики примет следующий вид:
Qv = ΔU = U2 - U1 (3)
Т.е. вся теплота, поступающая в систему или уходящая из системы, связана только с изменением внутренней энергии. Такая ситуация имеет место в закрытом сосуде, объем которого меняться не может. Подстрочный индекс "V" в формуле (3) показывает, что процесс протекает при постоянном объеме.
Для того чтобы разобрать второй случай, надо сначала получить выражение для работы системы против внешних сил. Будем считать, что имеется очень простая система: идеальный газ, находящийся в цилиндре с поршнем, который может перемещаться без трения (см. рис. 1).
|
|
|
 |
Рисунок 1 -К расчету работы расширения.
Если давление газа равно р, а площадь сечения цилиндра S, то сила, действующая на поршень, будет равна, соответственно:
F = p·S (4)
Теперь, если поршень переместится на высоту h, то работа расширения, совершенная газом, будет равна:
A = p·S·h (5)
Так как произведение площади основания на высоту равно объему тела, то формулу можно изменить следующим образом:
A = p ·ΔV = p(V2 -V1) (6)
где V2 и V1 - объемы системы, соответственно, после и до изменения
состояния системы.
Полученную формулу подставим в алгебраическое выражение для первого начала термодинамики:
Qp = (U2 - U1) + p(V2 - V1) (7)
Раскроем скобки и сгруппируем величины, соответствующие конечному и начальному состояниям системы:
Op = (U2 + pV2) - (U1 + pV1) (8)
Введем новую функцию состояния, которая больше величины внутренней энергии на величину работы расширения, и называется энтальпией:
H = U + pV (9)
Таким образом, теплота, поступающая или уходящая из системы при постоянном давлении, равна изменению энтальпии системы:
Qp = H2 - H1 = ΔH (10)
Являясь функцией состояния, энтальпия зависит только от начального и конечного состояний системы. Описанный случай изменения состояния системы может иметь место в открытом реакционном сосуде. Все процессы будут протекать при постоянном атмосферном давлении, что отражено в уравнениях (7), (8), (10) нижним индексом у символа теплоты.
Жидкие и твердые вещества расширяются или сжимаются незначительно при изменении состояния системы. Поэтому, при работе с конденсированными системами (жидкими или твердыми), изменением объема можно пренебречь. Работа в этом случае совершаться не будет, и, следовательно, тепловой эффект реакции подсчитывается как для систем при постоянном объеме, т.е., он равен изменению внутренней энергии.
Тепловые эффекты химических реакций и фазовых превращений изучаются в разделе химической термодинамики, называемом термохимией.
ТЕРМОХИМИЯ
Уравнения химических реакций, учитывающие тепловые эффекты, называются термохимическими уравнениями. Например:
2Н2(г.)+О2(г.) = 2Н2О(г.); ΔН = – 476 кДж.
Поскольку в химических превращениях теплота может как поглощаться, так и выделяться, то тепловой эффект реакции нужно характеризовать не только величиной, но и знаком. Химические процессы, сопровождающиеся выделением теплоты, называются экзотермическими. Процессы, идущие споглощением теплоты называются эндотермическими.
Исторически сложились две различные системы отсчета тепловых эффектов: термохимическая и термодинамическая. В первой системе знак теплового эффекта экзотермической реакции считается положительным (экзо – наружу), а знак теплового эффекта эндотермической реакции – отрицательным (эндо – внутрь). В термодинамике принята обратная система знаков. Если система поглощает теплоту, ставится положительный знак; если выделяет – отрицательный. В дальнейшем будем использовать только термодинамическую шкалу для тепловых эффектов химических реакций. Приведенный выше пример записан в термодинамической шкале, и он показывает, что взаимодействие двух молей водорода и одного моля кислорода с образованием двух молей газообразной воды сопровождается выделением 476 кДж теплоты. Для измерения теплоты используется также другая единица – калория (кал), которая связана с джоулем следующим соотношением: 1кал = 4,18Дж.
При записи термохимических уравнений коэффициенты могут быть как целыми, так и дробными, а тепловой эффект реакции указывается после уравнения через точку с запятой, как было показано выше.
Основным законом термохимии является закон Гесса, сформулированный им в 1836 году.
Тепловой эффект химических реакций, протекающих при постоянном давлении или при постоянном объеме, не зависит от числа промежуточных стадий, а определяется лишь начальным и конечным состоянием системы.
Закон Гесса можно проиллюстрировать следующей схемой (см. рис. 2) 
Рисунок 2.
Здесь переход из начального состояния А в конечное состояние В может проходить либо в одну стадию А → В, либо в несколько стадий А → С → D → → В. Тепловой эффект этого перехода не будет зависеть от пути и, следовательно,
ΔНАВ = ΔHАС + ΔHСD + ΔHDB
Таким образом, тепловой эффект какой-либо реакции можно получить "составляя" эту реакцию из нескольких других, известных нам реакций.
Пример 1. Определить тепловой эффект реакции
Mg(к.) + С(графит) + 3/2О2(г.)=MgCО3(к.); ΔНx =?,
если известны тепловые эффекты следующих процессов:
С(графит) +O2(г.) = СО2(г.); ΔН1 = – 393,5 кДж;
2Мg(к.) + O2(г.)= 2MgO(к.); ΔH2 = –1203,6 кДж;
MgO(к.) + CO2(r.) = MgCO3(к.); ΔН3 = – 117,7 кДж.
Решение. Чтобы получить искомое термохимическое уравнение, надо сложить первое уравнение со вторым, умноженным на 1/2, и, затем, с третьим. Сделайте это самостоятельно, работая с термохимическими уравнениями, как с алгебраическими. Сравнивая искомое и полученное уравнения, легко заметить, что для тепловых эффектов получается следующее соотношение:
ΔНx = ΔН1 + 1/2ΔН2 + ΔН3
Подставив значения величин, получим искомый результат. Проделайте арифметические действия самостоятельно (ΔНx = –1113 кДж).
Данный пример показывает, что закон Гесса можно использовать для получения тепловых эффектов тех реакций, скорости которых малы или проведение которых непосредственно невозможно. В данной задаче был получен тепловой эффект реакции образования карбоната магния. Приведенный пример, конечно, слишком простой. В реальной работе частоприходится использовать очень много известных реакций для получения теплового эффекта нужной нам реакции.
Знание тепловых эффектов реакций имеет огромное практическое и теоретическое значение. Эти данные применяются в таких областях человеческой деятельности как металлургия, химическая технология, использование различных видов топлива, ракетная техника и т.п. В научных исследованиях данные о тепловых эффектах дают возможность предсказать направление химического процесса, определить энергию межатомных связей в молекулах, энергию межмолекулярных взаимодействий, получить тепловой эффект реакций образования различных химических веществ и т.д.
Энтальпией (теплотой) образования химического соединения (ΔНобр или ΔН°298) – называется изменение энтальпии в процессе получения одного моля этого соединения из простых веществ, устойчивых при стандартных условиях (например, графит, ромбическая сера, белое олово, жидкий бром, кристаллический йод). Энтальпии образования простых веществ принимаются равными нулю. Исторически сложилось так, что в некоторых случаях простым веществом с точки зрения термодинамики считается не самая устойчивая при стандартных условиях модификация вещества. Так, простым веществом, наиболее устойчивым в стандартных условиях, считается белый, а не красный фосфор; белое, а не серое олово.
Стандартным состоянием вещества в твердой или жидкой фазах называется его реальное состояние при температуре 298 К и давлении 101,3 кПа. Стандартным состоянием газообразного вещества является состояние газа при парциальном давлении 101,3 кПа и Т = 298 К. Стандартному состоянию растворенного вещества отвечает концентрация его раствора 1 моль/л при Т = 298 К и Р = 101,3 кПа. Чтобы точно определить условия протекания химической реакции, в термохимических уравнениях указывается агрегатное состояние каждого вещества: CO2(г.) - газообразное, H2О(ж.) - жидкое, КОН(т.) – твердое или КОН(к.) – кристаллическое, MgCl2(p.) - растворенное. Если условия задачи требуют, то указывается также аллотропная модификация вещества: S(ромбическая), С(графит) и т.д.
В основе большинства термохимических расчетов лежит следствие из закона Гесса:
Тепловой эффект химической реакции равен сумме теплот (энтальпий) образования продуктов реакции за вычетом суммы теплот (энтальпий) образования исходных веществ
При проведении термохимических расчетов следует учитывать стехиометрические коэффициенты в уравнениях реакций. Так, для реакции, описываемой уравнением аА + вВ = сС + dD, тепловой эффект (ΔНр) равен:
ΔHр =[с·ΔHобр(С) + d·ΔНобр(D)] – [a·ΔHобр(A) + b·ΔHобр(B)] (11)
Уравнение (11) позволяет определить как тепловой эффект реакции по известным значениям теплот образования веществ, участвующих в реакции, так и одну из теплот образования, если известны остальные и тепловой эффект реакции в целом.
Пример 2.
Пользуясь следующими данными: ΔНо6р(СО2) = –393,5 кДж/моль; ΔHo6p(МgO) =– 601,8 кДж/моль, определить тепловой эффект реакции:
2Mg(к.) + СО2(г.) = 2МgО(к.) + С(графит); ΔHx=?
Решение: Пользуясь следствием из закона Гесса можно сразу записать требуемое выражение:
ΔНx = 2ΔНо6р(MgO) – ΔНо6р(СО2).
Проделайте арифметические действия самостоятельно и получите результат: ΔНx = – 801,1 кДж/моль.
Рассмотрим тепловые эффекты некоторых процессов, интересных для химика. Теплоты образования различных веществ обычно имеют значения в интервале от –1500 кДж/моль до + 500 кДж/моль, т.е. тепловой эффект реакции образования может быть как экзо- так и эндотермическим. Вещества, имеющие большие значения ΔНобр обладают значительным запасом внутренней энергии и поэтому являются неустойчивыми и реакционноспособными. Напротив, вещества с малыми, особенно отрицательными значениями ΔНобр являются, как правило, относительно инертными в химическом отношении. Сравните следующие величины: ΔНобр(С2Н2) = +226,8 кДж/моль и ΔНобр(СО2) = –393,5 кДж/моль. Нетрудно догадаться, какое извеществ является более устойчивым. Теплоты образования родственных соединений (например, оксидов элементов одной подгруппы периодической системы) часто подчиняются определенным закономерностям, которые вытекают из периодического закона Д.И. Менделеева.
Теплоты сгорания характеризуют тепловой эффект реакции взаимодействия веществ с кислородом при образовании, как правило, высших оксидов. Они, чаще всего, имеют отрицательные значения, и чем эти величины больше по абсолютной величине, тем эффективнее использование данного вещества в качестве топлива.
К химическим реакциям можно отнести и процессы распада ионных кристаллов на газообразные ионы. Например:
CsF(т.) = Cs+(г.) + F–(г.); ΔН = +762 кДж.
Тепловой эффект процессов такого рода называется энергией кристаллической решетки. Чем выше это значение, тем прочнее решетка кристалла, тем больше энергетические затраты на ее разрушение в процессе химического взаимодействия, тем инертнее ведет себя такое веществе в химическом отношении.
Тепловые эффекты процессов перехода из одного агрегатного состояния в другое (твердое → жидкое; жидкое → газообразное) обычно имеют значения до 100 кДж/моль. Подумайте, почему эти величины имеют положительные значения?
Процесс растворения вещества в воде также может сопровождаться тепловым эффектом. Теплоты растворения твердых кристаллических веществ чаще имеют положительные значения (ΔН>0), а теплоты растворения газов, наоборот – отрицательные (ΔН <0). Подумайте и постарайтесь объяснить эту закономерность самостоятельно.
3. Энтропия. Движущее начало
химических процессов.
Убедившись в полезности знания тепловых эффектов химических превращений, мы, тем не менее, не смогли ответить на вопрос: «Почему одни химические реакции возможны, а другие нет?». Что же является движущим началом любого химического превращения?
Первой попыткой ответить на этот вопрос можно считать сформулированный в 1867 году принцип Бертло - Томсена, согласно которому самопроизвольно протекают только экзотермические реакции, т.е. с DН<0.
Авторы этого положения не без основания полагали, что движущим началом химической реакции должно быть стремление системы к минимуму внутренней энергии.
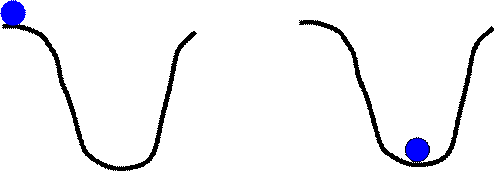 |
На рисунке показана механическая аналогия правила Бертло - Томсена. Шарик может самопроизвольно скатиться в ямку и это происходит за счет уменьшения его потенциальной энергии. Обратный же процесс - самопроизвольный подъем из ямки наверх невозможен.
Действительно, для многих реакций, в частности в конденсированной фазе (жидком и твердом состоянии) данный принцип выполняется.
Однако очень скоро обнаружилась ограниченность применимости этого положения. В первую очередь это касалось реакций с участием газообразных веществ. Оказалось, что значительное число реакций, эндотермических по тепловому эффекту, тем не менее, протекают самопроизвольно.
Такая ситуация потребовала от термодинамики поиска более общего критерия самопроизвольности протекания химических процессов.
Для решения этого вопроса надо ввести новую функцию состояния – энтропию S. Физический смысл данной функции можно рассмотреть на примере расширения газа. Рассмотрим идеальный газ в сосуде, разделенном перегородкой на два отделения.
 |
Если в первый момент времени газ занимает только одну половину сосуда, то после удаления перегородки, газ самопроизвольно займет весь объем. При этом процесс будет эндотермическим. На данном принципе и действует обычный холодильник. Рассмотренное явление противоречит принципу Бертло - Томсена. В нашем случае произошел, как говорят в термодинамике, переход системы в более разупорядоченное состояние.
Мерой разупорядочивания (беспорядка) и является величина функции энтропии S. Как и любая термодинамическая функция состояния, она не зависит от пути перехода из одного состояния в другое. Движущим началом, в данном случае, является стремление системы к более разупорядоченному состоянию, а мерой беспорядка и является энтропия.
Это можно сформулировать как второе начало термодинамики:
В изолированной системе самопроизвольно могут протекать процессы, сопровождающиеся возрастанием энтропии DS>0.
Энтропия связана с термодинамической вероятностью соотношением:
S = k · ln W, (12)
где k – константа Больцмана,
W – термодинамическая вероятность.
Разберем понятие термодинамической вероятности подробнее. Для этого введем понятия микро - и макросостояния.
Микросостояние характеризуется совокупностью всех параметров, описывающих все частицы данной системы (координата, скорость энергия и т.п.).
Макросостояние характеризуется параметрами всей совокупности частиц системы, то есть термодинамическими параметрами (давление, температура, количество вещества и т.п.).
Как правило, число микросостояний, отвечающих данному макросостоянию огромно. Действительно, несмотря на постоянное перемещение и соударение молекул в самой простой системе (газ в сосуде) и изменение параметров каждой частицы – макропараметры такой системы (температура, объем, давление и т.д.) могут оставаться неизменными.
Термодинамической вероятностью называется количество равновероятных микросостояний, соответствующих данному макросостоянию.
Можно провести аналогию, которая позволит лучше понять смысл термодинамической вероятности. Для этого вспомним одну из простейших азартных игр – кости. Играющие бросают определенное количество костей (например, три) и по сумме выпавших очков определяют победителя.
 | |||||||||||||
 | |||||||||||||
 | |||||||||||||
 | |||||||||||||
 | |||||||||||||
 | |||||||||||||
 |
Микросостоянием будем считать показания на каждой из костей, а макросостоянием – сумму очков на трех костях.
Для следующего примера микросостоянием является следующий набор
чисел: 6 1 3, а макросостоянием является сумма, равная 10.


 Теперь посмотрим, каким количеством микросостяний можно получить то или иное макросостояние. Например, сумму 18, равно, как и сумму 3 можно получить только одной из показанных ниже комбинаций:
Теперь посмотрим, каким количеством микросостяний можно получить то или иное макросостояние. Например, сумму 18, равно, как и сумму 3 можно получить только одной из показанных ниже комбинаций:
 | |||||||
 | |||||||
 | |||||||
 | |||||||
Таким образом, данное макросостояние можно получить только с помощью одного микросостояния. Но если нас интересует сумма 10, то ее можно получить уже многими способами, некоторые из которых показаны ниже:
 |  | ||||||||||
 | |||||||||||
 | |||||||||||
 | |||||||||||
 | |||||||||||





 Можно сделать вывод, что состояние со значением суммы очков равным 10 является более вероятным, чем состояние со значением суммы равным 18 или 3.
Можно сделать вывод, что состояние со значением суммы очков равным 10 является более вероятным, чем состояние со значением суммы равным 18 или 3.
Нечто подобное имеет место и в природе. Происходят только такие события, которые являются наиболее вероятными, т.е. реализуются большим числом микросостояний. Если же вспомнить, что в примере с газом в сосуде, молекул отнюдь не три, а значительно больше, го можно понять, почему газ самопроизвольно занял весь объем, а не собрался, к примеру, только в одной половине. Произошло просто термодинамически наиболее вероятное событие.
Конечно, теоретически можно предположить, что произойдет обратный процесс, т.е. молекулы газа вдруг соберутся в одной половине сосуда самопроизвольно. Однако вероятность такого события столь мала, что никто до сих пор ничего подобного не наблюдал.
Энтропию относят к 1 молю вещества, обозначают символом S, а в стандартных условиях – Sº298, и выражают в условных энтропийных единицах: э.е. = Дж/(моль • град). В тех же единицах выражают и изменение энтропии в ходе процесса, которое соответственно обозначают ΔS и ΔSº298. Последние представляют собой разность энтропий конечного и начального состояний вещества, а в более общем случае – разность суммы энтропий продуктов реакции и суммы энтропий исходных веществ с учетом их состояния.
Значение энтропии сильно зависит от различных факторов. С ростом температуры энтропия возрастает. Особенно сильно изменяется энтропия при переходе от одного агрегатного состояния к другому. Газообразное состояние более упорядочено, чем жидкое, поэтому превращение жидкости в газ сопровождается увеличением энтропии. Энтропия жидкости больше энтропии того же вещества в твердом состоянии. В таблице 1 указаны значения энтропии для различных агрегатных состояний воды.
Таблица 1. Энтропии для различных агрегатных состояний воды.
| Фаза Н2О | |||
| Н2О (к.) | Н2О (ж.) | Н2О (г.) | |
| Sº(энтр. ед.) | 39,4 | 70,1 | 188,7 |
Энтропия простых твердых веществ зависит от строения их аллотропных модификаций. Структура алмаза, например, более упорядочена, чем структура графита, и энтропии их составляют: Sº298(ал.) = 2,4 э.е.; Sº298(гр.) = 5,7 э.е.
Энтропия также зависит от числа частиц в системе. Как видно из таблицы 2, число атомов кислорода в обоих случаях одинаково, но существуют они в различных состояниях. Подобное изменение энтропии может происходить и при растворении твердого вещества. Объясните изменение энтропии в этом случае.
Таблица 2.Зависимость энтропии от числа частиц в системе.
| Количество вещества | ||
| 1 моль О3 | 3 моля О | |
| Sº(энтр. ед.) | 239,1 | 483,6 |
Если количество частиц в системе одинаково, то многое зависит от сложности строения этих частиц (таблица 3). Здесь указаны значения энтропии для одного моля каждого типа частиц.
Таблица 3. Зависимость энтропии от строения частиц в системе.
| Число частиц | |||
| О | О2 | О3 | |
| Sº(энтр. ед.) | 162,4 | 205,0 | 239,1 |
Энтропия также существенно зависит от молекулярной массы частиц. В таблице 4приведены значения энтропии для одного моля каждого из галогенов.
Таблица 4. Зависимость энтропии от молекулярной массы частиц.
| Частицы | ||||
| F2 | Cl2 | Br2 | I 2 | |
| Sº(энтр. ед.) | 200,9 | 222,9 | 247,0 | 259,6 |
Во всех случаях значение энтропии было выражено положительными числами, что не удивительно, если вспомнить определение энтропии. Однако не совсем понятно, от какого значения надо вести отсчет термодинамической вероятности.
Ответ на этот вопрос дает третье начало термодинамики:
Энтропия S равна нулю, и следовательно, термодинамическая вероятность W равна единице, при температуре абсолютного нуля (0 К) у идеально чистого и правильного кристалла.
Таким образом, для предсказания направления протекания химической реакции требуется учитывать не только энтальпийный, но и энтропийный фактор. Можно сказать, что термодинамическая система испытывает противоречивое стремление: с одной стороны, перейти в состояние с меньшей внутренней энергией, а, с другой стороны, перейти в состояние с наибольшей разупорядоченностью. В термодинамике была введена новая функция состояния, учитывающая оба эти стремления и названная свободной энергией Гиббса
G = H – T • S (13)
Она называется иначе изобарно-изотермическим потенциалом, что указывает на состояние системы (постоянное давление и постоянная температура). При этих условиях критерием самопроизвольности протекания процесса будет отрицательное значение изменения свободной энергии Гиббса, т.е. стремление к минимуму этой величины
ΔG = ΔH – TΔS < 0. (14)
Если ΔG < 0, то процесс может протекать самопроизвольно, если ΔG > 0 – процесс самопроизвольно при данных условиях протекать не может.
Поскольку функция G состоит из двух членов, то возможны четыре типичных случая:
1. ΔН < 0 (процесс экзотермический), ΔS > 0. Подставив эти
|
|
|


