 |
Химические и физические свойства
|
|
|
|
Барий — белый серебристый металл с объемно-центрированной кубической решеткой (модификация α-Ва устойчива ниже 375°, модификация β-Ва — от 375 до 710°). Плотность бария 3,74 г1см3, твердость 3 по шкале Мооса (тверже свинца). Ковкий металл. При загрязнении ртутью становится хрупким. Т. пл. 710°, т. кип. 1696°. Соли бария окрашивают пламя газовой горелки в желто-зеленый цвет.
Самый важный радиоактивный изотоп бария — (β- и γ-активный 140Ва — образуется при распаде урана, тория и плутония; период полураспада 13,4 дня. 140Ва извлекают хроматографически из смеси продуктов распада. Распад изотопа 140Ва сопровождается выделением радиоактивного 140La.
При облучении цезия дейтронами образуется ядерный изотоп 133Ва с периодом полураспада 1,77 дней. Со свинцом, никелем, сурьмой, оловом и железом барий образует сплавы.
Барий химически активнее кальция и стронция. Металлический барий хранят в герметичных сосудах под петролейным эфиром или парафиновым маслом. На воздухе металлический барий теряет блеск, покрывается коричневато-желтой, а затем серой пленкой окиси и нитрида:
Ва + 1/202 = Ва0 + 133,1 ккал.
ЗВа +N2 = Ba3N2 + 89,9 ккал
Под действием галогенов металлический барий образует безводные галогениды ВаХ2 (X == F ˉ, С1ˉ, Вг ˉ, I ˉ). Металлический барий разлагает воду:
Ва + 2Н2О = Ва(ОН)2 + 112 + 92,5 ккал
Растворение металлического бария в жидком аммиаке (—40") сопровождается образованием аммиаката Ba(NH3)6-При обычной температуре барий реагирует с двуокисью углерода:
5Ва + 2C02 = ВаС2 + 4Bа0
Металлический барий — сильный восстановитель. С его помощью при восстановлении хлорида америция (1100°) и фторида кюрия (1300°) были получены элементы америций (N 95) и кюрий (N 96). При высокой температуре барий восстанавливает закись углерода, а выделяющийся свободный углерод реагирует с барием с образованием карбида ВаС2.
|
|
|
Приведенная ниже схема иллюстрирует химическую активность бария.

Растворимые соли бария чрезвычайно ядовиты. Введенный внутривенно хлорид бария мгновенно вызывает смерть. Карбонат и сульфит бария ядовиты, так как они растворяются в соляной кислоте, которая содержится в желудочном соке.
ПРИМЕНЕНИЕ
Металлический барий применяется для металлотермического восстановления америция и кюрия, в антифрикционных сплавах на основе свинца, а также в вакуумной технике. Сплавы свинец — барий вытесняют полиграфические сплавы свинец — сурьма.
СОЕДИНЕНИЯ (ОБЩИЕ СВОЙСТВА)
Известны многочисленные соединения, в которых барий присутствует в виде двухвалентного катиона. Ион Ва2+ бесцветен, имеет устойчивую восьмиэлектронную конфигурацию. Радиус иона 1,34 А. Он обладает относительно большим объемом и слабо выраженной тенденцией к поляризации, поэтому не образует устойчивых комплексных соединений. Гидроокись Ba(OH)g представляет собой сильное основание.
Неорганические соединения
Гидрид бария, ВаН2, получают нагреванием металлического бария, сплавов кадмий — барий, ртуть — барий или окиси бария в атмосфере водорода:
Ва + Н2 = ВаН2 + 55 ккал Ва0+ 2Н2 = BaH2 + Н2О
BaH2 — серовато-белые кристаллы с плотностью 4,21 г/см3. Выше 675° они подвергаются термической диссоциации. Гидрид бария разлагает воду и взаимодействует с азотом, соляной кислотой и аммиаком.
Гидрид бария применяют в качестве катализатора реакций гидрогенизации.
Окись бария, ВаО, получают непосредственным синтезом из элементов. Кроме того, используют термическое разложение гидроокиси, перекиси, карбоната или нитрата бария. Применяют также прокаливание смеси карбоната бария с углем, сульфата бария с односернистым железом или нагревание сульфида бария с окисью магния и водой.
|
|
|
ВаО представляет собой кубические (решетка типа NaCI) или гексагональные бесцветные кристаллы (или белый аморфный порошок), очень гигроскопичные, с плотностью 5,72 г/см3 (для кубической модификации) и 5,32 г/см3 (для гексагональной) и твердостью 3,3 по шкале Mooca; т. пл. 1923°, т. кип. 2000°. Ва0 люминесцирует под действием ультрафиолетовых лучей и фосфоресцирует в рентгеновских лучах.
Растворяясь в воде, окись бария дает гидроокись бария Ba(OH)2. В отличие от окислов кальция и стронция окись бария при температуре 500° в заметных количествах поглощает двуокись углерода. На холоду окись бария взаимодействует с хлором, а при нагревании — с кислородом, серой, азотом, углеродом, двуокисью серы, сероуглеродом, двуокисью кремния, двуокисью свинца, окисью железа, хрома, а также с солями аммония.
При нагревании окись бария восстанавливается магнием, цинком, алюминием, кремнием и цианидами щелочных металлов.
Окись бария применяют для изготовления стекла, эмалей и термо' катализаторов. В результате замещения в цементе окиси кальция окисью бария получают цементы с исключительной устойчивостью по отношению к воде, содержащей сульфат-ионы.
Перекись бария, ВаО2, получают, сильно прокаливая гидроокись, нитрат или карбонат бария в токе воздуха в присутствии следов воды. Другие способы получения: непосредственный синтез из элементов при нагревании, прокаливание окиси бария с окисью меди, нагревание окиси бария с хлоратом калия, нагревание окиси бария до 350°, дегидратация кристаллогидрата
BaO2*8H2O при 120°:
Ва + 02 = Ва02 + 145,7 ккал Ba0 + СиО = Ва02 + Сu
Ba0 +1/2 02 = Ва02 + 12,1 ккал 3ВаО + КclO3 = ЗВа02 + КСl
Ba02 представляет собой белый парамагнитный порошок с плотностью 4,96 г1см3 и т. пл. 450°. Он разлагается до Ba0 (600°) или до кислорода (795°), устойчив при обычной температуре (может храниться годами), плохо растворяется в воде, спирте и эфире, растворяется в разбавленных кислотах.
Термическое разложение перекиси бария ускоряют окислы - СеО, Cr2O3,
Fe2 O3 и Cu0.
Известны кристаллогидраты BaO2*8H2O и BaO2H2O. Октагид-рат Ba02•H2O получают действием перекиси водорода на баритовую поду в слабощелочных растворах, а также обработкой на холоду раствора хлорида пли гидроокиси бария перекисью натрия:
|
|
|
Ва(ОН)2 + H2O2 + 6H2O = Ва02*8Н2О
BaO2*8H2O выделяется в виде бесцветных гексагональных кристаллов, трудно растворимых в воде, спирте, эфире. Нагретое с перекисью водорода это соединение превращается в желтое вещество — надперекнсь бария ВаО^.
Перекись бария реагирует при нагревании с водородом, серой, углеродом, аммиаком, солями аммония, феррицианидом калия и т. д.
С концентрированной соляной кислотой перекись бария реагирует, выделяя хлор:
ВаO2 + 4НС1конц. = BaCl2 + Cl2 + 2H2O
Перекись бария восстанавливает соли благородных металлов (обладающие малой химической активностью) до соответствующего металла. Перекись бария применяют для получения перекиси водорода, в зажигательных бомбах, а также в качестве катализатора крекинг-процесса.
BaO2•H2O2 представляет собой желтые моноклинные микрокристаллы, устойчивые при 0°, трудно растворимые в обычных растворителях.
Гидроокись бария, Ва(ОН)2, получают действием воды на металлический барий или ВаО. Используют также обработку растворов солей бария (особенно нитрата) щелочами. В промышленности применяют действие перегретого пара на сульфид бария. С этой же целью можно нагреть до 175" (под давлением) метаспликат бария BaSiOs с раствором NaOH. Описан метод, основанный на восстановлении перекиси бария при 550°:
Ba(OH)2— белый порошок с плотностью 4,495 г/см3 и т. пл. 408°. В катодных лучах гидроокись бария фосфоресцирует желто-оранжевым цветом. Растворяется в воде, трудно растворима в ацетоне и метплацетате.
При растворении Ва(ОН)2 в воде получается бесцветный раствор с сильно щелочной реакцией — баритовая вода, которая в присутствии двуокиси углерода быстро покрывается поверхностной пленкой карбоната бария.
Известны кристаллогидраты Ва(ОН)2*8Н2О, Ва(ОН)2*7H2O, Ва(ОН) •2Н2O и Ва(ОН)2*H2O. Кристаллогидрат Ва(ОН)2*8H2O выделяется в виде бесцветных моноклинных призм с плотностью 2,18 г/cм3 и т. пл. 78°. При нагревании до 650° в токе воздуха кристаллогидрат превращается в окись или перекись бария.
|
|
|
Пропускание хлора через баритовую воду сопровождается образованием хлорида, хлората и очень незначительных количеств гино-хлорита бария:
6Ва(ОН)2 + 6CL2 = 5BaCl2 + Ва(ClO3)2 + 6H2О
Баритовая вода реагирует при 100° с сероуглеродом:
2Ва(ОН)2 + CS2 = ВаСО3 + Ba(HS)2 + H2O
Металлический алюминий взаимодействует с баритовой водой с образованием гидроксоалюмината бария и водорода:
2Аl + Ва(ОН)2 + 10H2O = Ba[Al(OH)4(H2O)2]2+3H2
Выше 1000° гидроокись бария подвергается термической диссоциации:
Ва(ОН)2 → ВаО + Н2O
Баритовая вода Ва(ОН)2 применяется в качестве очень чувствительного химического реактива на двуокись углерода.
Фторид бария, BaF2, получают непосредственным синтезом из элементов, действием фтористого водорода на окись, гидроокись, карбонат или хлорид бария, обработкой баритовой воды фтористо-водородной кислотой, обработкой нитрата или хлорида бария фто-ридом натрия или калия, а также сплавленном хлорида магния с фторидом кальция или магния в атмосфере CO2 и термическим разложением гексафторосиликата бария в атмосфере инертного газа.
Бесцветные кубические кристаллы BaF2 имеют решетку типа CaF2 с расстоянием между центром иона Ва2+ и иона Fֿ 2,68 А. Плотность 4,83 г/см3, т.пл. 1280°, т. кип. 2137°. Кристаллы мало растворимы в воде (1,63 г/л при 18°), растворяются в фтористоводо-родной, соляной и азотной кислотах. Применяются для изготовления эмалей и оптических стекол. Температура плавления смеси BaF2*LiF 850°, а смеси BaF2*BaCl2 1010°.
ПОЛУЧЕНИЕ ТИТОНАТА БАРИЯ
Под титанатом бария понимают соединение BaO-TiO2, в котором соотношение катионов и анионов может быть различным от BaTiO3 до Ba6Ti17O40, промежуточные вещества – политканаты нестехлометричны и в них могут добавлены вещества, частично замещающие Ba и Ti, то есть проведено легирование.
BaTiO3 имеет структуру неравномерно, а с кубической гране или объёмо-центрированной кристаллической решёткой. Кубическая структура характерна до 120 °C.
При более низких температурах происходит искажения структуры, она переходит в тирагональную, и, возникает деформация кислородной подрешётки, как Ti несколько смещается.
Деформация вызывает поляризацию. Для иона существует 2 энергетически равновесных стабильных положения, симметричных относительно центра. Направление поляризации едино внутри домена так как поляризация возникает без внешнего … поля, то она спонтанная. Внешнее напряжение вызывает упорядочение ориентации диполей. Между поляризацией и напряжённостью поля возникает гистерезисы.
При Т>120°C=Тс сегнетоэлектрические свойства пропадают из за высоты симметрии кристалла (кубическая структура). При Т>Тс диэлектрическая проницаемость Еr зависит от температуры поз Кюри-Вейтса
|
|
|
Хорошие нелигированные вещества BaTiO3 – диэлектрики. С D Е~ 3Эв. И тип энергия активации докоров 0,1 Эв. То есть при номинальной температуре эти носители полностью ионизированы. Кроме легированных элементов роль донора играет кислородные вариации при кислородной мстехлометрии за счёт отчёта.
s =rBaTiO3-1»10ом-1м-1
Nd»5*10^25м-3
Из РЭДС и Холла
Таким образом часть примеси носит акцепторный характер. Акцепторы захватывают электроны и на поверхности кристалита создаётся отрицательный поверхностный заряд. Отрицательный поверхностный заряд вызывает увеличение электростатического потенциала на границе зерна. Удельная проводимость зависит от высоты потенциального барьера С ростом температуры проводимость растёт. Для сохранения электронейтральности образца в приповерхностном слое кристалла возникает положительный пространственный заряд. В том слое, толщиной S подвижных носителей заряда мало и плотность. Пространственный заряда определяется практически только легирующей примесью доноров nD
r =e*nд
Внутри кристалла отсутствуют акцепторы, способные компенсировать доноры.
Если А – площадь приповерхностной области с глубиной ОЗ “S”, то
r*А*S – приграничный “+” ОЗ
N’а – концентрация акцепторов, захвативших электроны, заряд ОПЗ “-” e* N’а
По условию нейтронейтральности
r*А*S- e* N’а=0 ® S= 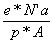 =
= 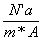
По уравнению пуассона потенциал ПЗ
Dj =-r /(x r*x 0) так как r=e*nд, a*x? S
j 0=(e/(2*nд*x r*x 0))*(N’a/A)^2
b - константа, связанная с N’a По полученному уравнению с ростом температуры R растёт.
В некотором интервале температур так как при высокой температуре Nа уменьшается из за высвобождения электронов с захваченных по границам зёрнен.
|
|
|
12 |


