 |
Поверхностная активность. Поверхностно-активные и поверхностно-инактивные вещества. Анализ уравнения Гиббса. ПАВ. Эффект Ребиндера. Правило Дюкло-Траубе
|
|
|
|
В уравнении Гиббса влияние природы вещества на адсорбцию отражается производной  . Эта производная определяет и знак гиббсовской адсорбции, и может служить характеристикой вещества при адсорбции. Чтобы исключить влияние концентрации на производную берут ее предельные значения, т.е. при стремлении концентрации к нулю. Эту величину Ребиндер назвал поверхностной активностью.
. Эта производная определяет и знак гиббсовской адсорбции, и может служить характеристикой вещества при адсорбции. Чтобы исключить влияние концентрации на производную берут ее предельные значения, т.е. при стремлении концентрации к нулю. Эту величину Ребиндер назвал поверхностной активностью.
 ;
;
g = [Дж×м/моль] = [Н×м2/моль]; [эрг см/моль] = [Гиббс].
Уравнение показывает, что чем сильнее снижается  = f (c) с увеличением концентрации, тем больше поверхностная активность этого вещества.
= f (c) с увеличением концентрации, тем больше поверхностная активность этого вещества.
Физический смысл поверхностной активности состоит в том, что она представляет силу, удерживающую вещество на поверхности и отнесенную к единице гиббсовской адсорбции.
Поверхностную активность можно представить как отрицательный тангенс угла наклона к касательной, проведенной к кривой Г = f (C) в точке пересечения с осью ординат. Поверхностная активность может быть положительной и отрицательной. Значение и знак ее зависят от природы растворенного вещества и растворителя.
1.  2<
2<  1, тогда
1, тогда  <0 и Г>0: g >0 Þ с увеличением концентрации поверхностное натяжение на границе раздела фаз убывает и вещество поверхностно-активно.
<0 и Г>0: g >0 Þ с увеличением концентрации поверхностное натяжение на границе раздела фаз убывает и вещество поверхностно-активно.
1.  2<
2<  1, то g <0: Г <0 Þ вещество поверхностно-инактивно.
1, то g <0: Г <0 Þ вещество поверхностно-инактивно.
2. g = 0, Г = 0 - адсорбции нет, т.е. вещество индифферентно.
Поверхностно-активными веществами являются органические вещества, состоящие из углеводородного радикала и функциональной группы. Неорганические соли являются поверхностно-инактивными веществами. Ребиндер и Щукин в своих работах показали, что развитие микротрещин в твердых телах при деформации может происходить гораздо легче при адсорбции веществ из среды, в которой ведется деформирование: адсорбироваться могут как ионы электролитов, так и молекулы поверхностно-активного вещества (ПАВ), образуя на адсорбирующей поверхности их двумерный газ в результате нелокализованной адсорбции. Молекулы под давлением этого газа проникают в устье трещин и стремятся раздвинуть их, таким образом содействуя внешним силам, т.е. наблюдается адсорбционное понижение твердости твердого тела, что получило название эффекта Ребиндера. Поверхностная активность в гомологическом ряду поверхностно-активных веществ (ПАВ) повышается в среднем в 3,2 раза на каждую группу СН2 (в водных растворах) – правило Дюкло – Траубе.
|
|
|
Адсорбционные равновесия
Адсорбционное равновесие в системе «газ – жидкость». Закон Генри. Мономолекулярная адсорбция в системах «газ – жидкость», «жидкость – жидкость», «газ – твердое». Изотерма адсорбции Ленгмюра. Уравнение Фрейндлиха. Теория полимолекулярной адсорбции БЭТ. Уравнение БЭТ
Предположим, что имеются компоненты-неэлектролиты. Будем считать, что адсорбат образует на поверхности адсорбента мономолекулярный слой. Мономолекулярная адсорбция с точки зрения термодинамики процесса выражается химическим потенциалом в адсорбционном слое и объемной фазе:
 ;
;
 ;
;
 ,
,
где  - химический потенциал вещества в адсорбционном слое;
- химический потенциал вещества в адсорбционном слое;
 - химический потенциал вещества в объемной фазе.
- химический потенциал вещества в объемной фазе.
При равновесии потенциалы равны:  .
.
Преобразуем:
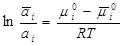 ;
;  – адсорбция; а i = c.
– адсорбция; а i = c.
 ,
,
 , где D - коэффициент распределения.
, где D - коэффициент распределения.
Выражение  - константа Генри. Она не зависит от концентрации, определяется при постоянной температуре, A / a = K г,
- константа Генри. Она не зависит от концентрации, определяется при постоянной температуре, A / a = K г,
А=а × Кг – закон Генри, т.е. при разбавлении системы коэффициент распределения стремится к постоянному значению, равному константе Генри. Если концентрация в сорбционном слое стремится к нулю, то а» с; а = × с; à 1. Поэтому на практике закон Генри используют в следующем виде: а=Кгс i. Если одна из фаз – газ, то имеем следующий вид: a = КгР i,
|
|
|
Кг = Кг/ RT.

Эти уравнения представляют собой уравнения изотермы адсорбции при малых концентрациях. В соответствии с этими уравнениями можно по другому сформулировать закон Генри: величина адсорбции при малых давлениях газа (малых концентрациях вещества в растворе) прямо пропорциональна давлению (концентрации). Эти зависимости показаны на рисунке 2.3.1.1. При адсорбции на твердых телах область действия закона мала из-за неоднородности поверхности, но даже на однородной поверхности при увеличении концентрации обнаруживается отклонение от закона. При малых концентрациях распределенного вещества отклонения обусловлены в основном соотношением между взаимодействием молекул друг с другом и с поверхностью адсорбента. Если когезионные взаимодействия адсорбата больше, то отклонение от закона отрицательно и <1, и коэффициент распределения увеличивается (кривая 1 на рис. 2.3.1.1). Если сильнее взаимодействие «адсорбат – адсорбент», то отклонение положительно и D уменьшается (кривая 2 на рис. 2.3.1.1). При дальнейшем увеличении концентрации происходит уменьшение свободной поверхности, снижается реакционная способность и кривые загибаются к оси абсцисс. Константу Генри получают экстраполяцией коэффициента распределения на нулевую концентрацию. В соответствии с правилом фаз Гиббса в гетерогенных системах равновесные параметры зависят от дисперсности или удельной поверхности. Для адсорбционных систем эта зависимость выражается в уменьшенных концентрациях вещества в объемной фазе с увеличением удельной поверхности адсорбента. Если в такой системе содержание распределяемого вещества постоянно, то
А mS уд + с V = const,
где m - масса адсорбента;
S уд - удельная поверхность адсорбента;
V - объем фазы, из которой извлекается вещество;
const – постоянное количество вещества в системе.
 ,
,
 или
или  : разделим второй член на с;
: разделим второй член на с;
D - коэффициент распределения;
 ;
;  .
.
Из соотношения следует, что с увеличением удельной поверхности при постоянной концентрации адсорбата концентрация уменьшается и тем сильнее, чем больше константа Генри и меньше объем фазы.
|
|
|
Теория Ленгмюра позволяет учесть наиболее сильные отклонения от закона Генри, что связано с ограничением адсорбционного объема или поверхности адсорбента. Ограниченность этого параметра приводит к адсорбционному насыщению поверхности адсорбента по мере увеличения концентрации распределяемого вещества. Это положение уточняется следующими утверждениями.
1. Адсорбция локализована на отдельных адсорбционных центрах, каждый из которых взаимодействует только с одной молекулой адсорбента - образуется мономолекулярный слой.
2. Адсорбционные центры энергетически эквивалентны - поверхность адсорбента эквипотенциальна.
3. Адсорбированные молекулы не взаимодействуют друг с другом.
Ленгмюр предположил, что при адсорбции происходит квазихимическая реакция между распределяемым компонентом и адсорбционными центрами поверхности:
 ,
,
 где А - адсорбционые центры поверхности;
где А - адсорбционые центры поверхности;
 В - распределенное вещество;
В - распределенное вещество;
АВ - образующийся комплекс на поверхности.
Константа равновесия процесса:  ,
,
где сав = А - величина адсорбции;
са = А0 = А ¥ - А,
где А ¥ - емкость адсорбционного монослоя или число адсорбционных центров, приходящихся на единицу поверхности или единицу массы адсорбента; А 0 - число оставшихся свободных адсорбционных центров, приходящихся на единицу площади или единицу массы адсорбента; с в – концентрация распределенного вещества.
Подставляя величину концентрации в уравнение константы, получим выражения
 , св = с,
, св = с,
А = А ¥ Кс – АКс, 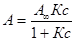 - для жидкостей;
- для жидкостей;
 - для газов.
- для газов.
Эти выражения – уравнения изотермы адсорбции Ленгмюра. К и Кр в уравнении характеризуют энергию взаимодействия адсорбента с адсорбатом. Адсорбционное уравнение часто представляют относительно степени заполнения поверхности, т.е. как отношение А/А ¥:
 ,
,
 .
.
Экспериментальные результаты по определению изотермы адсорбции обычно обрабатывают с помощью уравнения, записанного в линейной форме;
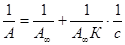 , т.е. уравнение типа y = b + ax.
, т.е. уравнение типа y = b + ax.
Такая линейная зависимость позволяет графически определить А ¥ и К. Зная А ¥, можно определить удельную поверхность адсорбента (поверхность единицы массы адсорбента):
|
|
|
 ,
,
где А ¥ - предельная адсорбция, выражаемая числом молей адсорбата на единицу массы адсорбента;
NA – число Авогадро;
w0 – площадь, занимаемая одной молекулой адсорбата.
1. Если сà 0, тогда уравнение примет вид:
А=А ¥ Кс; 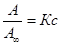 ; А = Кгс, q =Кс,
; А = Кгс, q =Кс,
т.е. при сà 0 уравнение Ленгмюра переходит в уравнение Генри.
2. Если сà¥, тогда А = А ¥, А/А ¥ = 1. Это случай предельной адсорбции.
3. Пусть адсорбция идет из смеси компонентов, в этом случае уравнение Ленгмюра записывается следующим образом:
 .
.
Все рассмотренные выше уравнения справедливы для мономолекулярной адсорбции на адсорбенте с энергетически эквивалентными адсорбционными центрами. Однако реальные поверхности этим свойством не обладают. Приближенной к реальности является возможность распределения адсорбционных центров по энергии. Приняв линейное распределение, Темкин использовал формулу уравнения Ленгмюра и получил уравнение для средних степеней заполнения адсорбента.
 ,
,
где - константа, характеризующая линейное распределение;
К 0 - константа уравнения Ленгмюра, отвечающая максимальной теплоте адсорбции.
Из уравнения следует, что увеличение парциального давления (из-за увеличения концентрации) одного компонента подавляет адсорбцию другого и тем сильнее, чем больше его адсорбционная константа равновесия. Уравнение часто называют логарифмической изотермой адсорбции. Если принять экспоненциальное распределение центров по поверхности, то в области средних заполнений получается ранее найденное эмпирическим путем уравнение Фрейндлиха:
 .
.
Прологарифмировав, получим 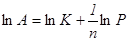 ,
,
где K, n – постоянные.
Использование уравнения Фрейндлиха в логарифмической форме позволяет определить константу уравнения.
Уравнение Ленгмюра можно использовать только при адсорбции в мономолекулярном слое. Это условие выполняется при хемосорбции, физической адсорбции газов при меньшем давлении и температуре выше критической. Однако в большинстве случаев мономолекулярный адсорбционный слой не компенсирует полностью избыточную поверхностную энергию и поэтому остается возможность влияния поверхностных сил на второй и т.д. адсорбционные слои. Это реализуется в том случае, когда газы и пары адсорбируются при температуре ниже критической, т.е. образуются полимолекулярные слои на поверхности адсорбента, что можно представить как вынужденную конденсацию (рис. 2.3.1.2 и 2.3.1.3).

В результате этих представлений была выведена следующая формула:
|
|
|
 - уравнение полимолекулярной адсорбции БЭТ,
- уравнение полимолекулярной адсорбции БЭТ,
где  ;
;
KL = a ж /ап – константа конденсации пара;
аж - активность вещества в жидкости;
ап - активность вещества в состоянии насыщенного пара;
ап = Р s.
Физический смысл С: характеризует разность энергии Гиббса в процессах чистой адсорбции и конденсации. Это уравнение получило название БЭТ (Бранауэр-Эммет- Теллер).
При р/р s <<1, уравнение БЭТ превращается в уравнение Легмюра, которое при дальнейшем уменьшении давления (Рà 0) переходит в закон Генри:
 .
.
При обработке экспериментальных данных уравнение БЭТ используют в линейной форме (рис. 2.3.1.4):

 ;
;  ,
,
таким образом графически находят обе константы уравнения А¥ и С.
|
|
|
12 |


