 |
Химические свойства фенола
|
|
|
|
А15. Характерные химические свойства предельных одноатомных и многоатомных спиртов; фенола
Характерные химические свойства предельных одноатомных спиртов
| Тип реакции | Уравнение |
| I. Реакции окисления | |
| 1. Горение (полное окисление) | 2СН3ОН + 3О2 → 2СО2 + 4Н2О С2Н5ОН + 3О2 → 2СО2 + 3Н2О |
| 2.Неполное окисление (CuO, растворы KMnO4, K2Cr2O7). Первичные спирты – до альдегидов, вторичные – до кетонов. | t C2H5OH + CuO → CH3COH + Cu+H2О качественная реакция K2Cr2O7 + 3C2H5OH + 4H2SO4 → 3CH3COH + Cr2(SO4)3 + K2SO4 + 7H2O С избытком окислителя (KMnO4, K2Cr2O7) в любой среде первичные спирты окисляются до карбоновых кислот или их солей, а вторичные – до кетонов. Третичные спирты в этих условиях не окисляются, а метиловый спирт окисляется до углекислого газа. |
| 3. Ферментативное брожение (окисление) жидкостей, содержащих спирт (вино, пиво) | ферменты C2H5OH + О2 → CH3CОOH + H2О |
| II. Реакции с разрывом связи О – Н | |
| 1. Как слабые кислоты взаимодействуют со щелочными и щелочноземельными металлами (со щелочами не взаимодействуют) | 2C2H5OH+2Na → 2C2H5ONa + H2 этилат натрия |
| 2. Реакция этерификации-взаимодействие спиртов с органическими кислотами с образованием сложных эфиров | H2SО4 конц.,t CH3COOH + C2H5OH→ CH3COOC2H5+ H2О |
| III. Реакция с разрывом связи С – О | |
| 1. Гидрогалогенирование | к. H2SO4, t C2H5OH + HC1→ C2H5C1+ H2О |
| 2. Дегидратация: а) внутримолекулярная – образуются алкены | к. H2SO4, t >150°C C2H5OH → C2H4 + H2О |
| б) межмолекулярная - образуются простые эфиры | H2SО4, t <150°C 2C2H5OH → C2H5OC2H5 + H2О диэтиловый эфир |
| IV. Дегидрирование спиртов | |
| 1. При пропускании паров спирта при 200-300оС над металлическим катализатором (Cu, Ag, Pt) первичные спирты превращааются в альдегиды, а вторичные – в кетоны | Cu C2H5OH → CH3COH + H2 |
| V. Дегидратация и дегидрирование (реакция Лебедева) | |
| Дегидратация и дегидрирование - образуются алкадиены | 2CH3-CH2 - OH → CH2=CH-CH=CH2 + 2H2O + H2 бутадиен-1,3 |
|
|
|
Характерные химические свойства предельных многоатомных спиртов
Сходство этиленгликоля и глицерина с одноатомными спиртами:
1. Так, они реагируют с активными металлами:
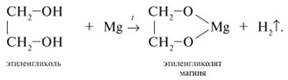
2. Многоатомные спирты в реакции с галогеноводородами обменивают одну или несколько гидроксильных групп ОН на атомы галогена:
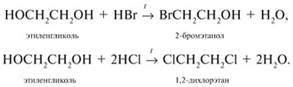
3.Глицерин взаимодействует с азотной кислотой с образованием сложных эфиров. В зависимости от условий реакции (мольного соотношения реагентов, концентрации катализатора – серной кислоты и температуры) получаются моно-, ди- и тринитроглицериды:
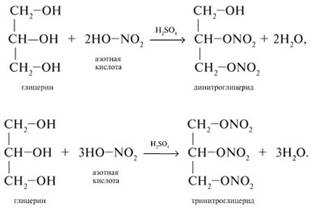
Отличия этиленгликоля и глицерина от одноатомных спиртов:
1. Качественная реакция многоатомных спиртов, позволяющая отличить соединения этого класса, – взаимодействие со свежеприготовленным гидроксидом меди(II). В щелочной среде при достаточной концентрации глицерина голубой осадок Cu(OH)2 растворяется с образованием раствора ярко-синего цвета – гликолята меди(II):
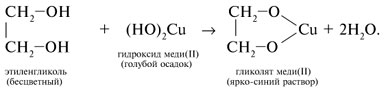
Окисление этиленгликоля
Двухатомный спирт, этиленгликоль HOCH2–CH2OH, при нагревании в кислой среде с раствором KMnO4 или K2Cr2O7 легко окисляется до щавелевой кислоты, а в нейтральной – до оксалата калия.
5СН2(ОН) – СН2(ОН) + 8КMnO4 - +12H2SO4→5HOOC – COOH +8MnSO4 +4К2SO4 +22Н2О
3СН2(ОН) – СН2(ОН) + 8КMnO4→3KOOC – COOK +8MnO2 +2КОН +8Н2О
Химические свойства фенола
Кислотные свойства фенола (карболовой кислоты) выражены сильнее, чем у воды и предельных спиртов, что связано с большей полярностью O—H связи и с большей устойчивостью образующегося при ее разрыве фенолят-иона. Однако кислотные свойства фенола выражены слабее, чем у карбоновых кислот и, тем более, у сильных неорганических.
| Тип реакции | Уравнение |
| I. Окисление | |
| 1. Полное окисление (горение) | С6Н5ОН+7О2 → 6СО2 + ЗН2О |
| II. Реакции с участием ФГ ОН | |
| 1. Реагируют со щелочными и щелочноземельными металлами, образуя феноляты (сходство со спиртами). | 2C6H5ОH+2Na → 2C6H5ONa + H2 |
| 2. Реагируют с растворами щелочей, образуя феноляты (отличие от спиртов). | C6H5OH+NaOH → C6H5ONa + H2О |
| 3. Качественная реакция с хлоридом железа(III). Образуется комплексное соединение фиолетового цвета - фенолят железа. | C6H5OH + FeCl3 → (C6H5O)3Fe + 3HCl фенолят железа |
| III. Замещение в бензольном кольце | |
| 1. Реакция с бромной водой (качественная реакция). Галогенирование идёт при обычных условиях. |  + 3Br2 → + 3Br2 →  +3HBr
Или С6Н5ОН+ ЗВг2 → С6Н2Вг3ОН + ЗНВr
Образуется 2,4,6-трибромфенол - осадок бело-жёлтого цвета. +3HBr
Или С6Н5ОН+ ЗВг2 → С6Н2Вг3ОН + ЗНВr
Образуется 2,4,6-трибромфенол - осадок бело-жёлтого цвета.
|
| 2. Нитрование (при комнатной температуре), применяется нитрующая смесь – смесь конц. азотной и серной кислот при нагревании. |  + 3HNO3(конц.) → + 3HNO3(конц.) → 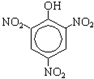 +3H2O
Образуется 2,4,6-тринитрофенол (пикриновая кислота)- С6Н5(NО2)3OН. +3H2O
Образуется 2,4,6-тринитрофенол (пикриновая кислота)- С6Н5(NО2)3OН.
|
| IV. Поликонденсация | |
| 1. Поликонденсация фенола с формальдегидом (по этой реакции происходит образование фенолформальдегидной смолы). | 
|
|
|
|
|
|
|


