 |
Фазы в железоуглеродистых сплавах
|
|
|
|
Железоуглеродистые сплавы
Железоуглеродистые сплавы ─ стали и чугуны ─ важнейшие металлические сплавы (93% всех конструкционных материалов) максимальное содержание углерода в сплавах – 6,67%
В настоящее время на смену сталям идут другие сплавы: Ti, Al, Ni, Mg-вые и неметаллические материалы. 
Стали – это сплавы Fe–C с содержанием углерода от 0,025 до 2,14%.
Чугун – сплавы Fe–C с содержанием углерода от 2,14 до 6,67%.
Стали и чугуны ─ многокомпонентные сплавы, но основной элемент это углерод.
Д.К. Чернов дал первое представление о диаграмме Fe – C.
Компоненты железоуглеродистых сплавов
Железо (Fe): №26 (Периодическая система элементов Д.И. Менделеева), атомная масса 55,58
атомный радиус 0,127 нм
Чистое железо (химически чистое) содержит 99,999% Fe. Технически чистое железо содержит 99,8 – 99,9% Fe
О чистоте железа судят по многим факторам (содержание% С, цветных металлов, других примесей). Температура плавления железа 1539º С. Известно три модификации железа:  (
( ─ Fe,
─ Fe,  ─ Fe,
─ Fe, 
 ─ Fe).
─ Fe).
Собственно 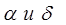 железо ─ имеет одно кристаллическое строение;
железо ─ имеет одно кристаллическое строение;  ─ высокотемпературная модификация, существует в интервале 1392─1539ºС;
─ высокотемпературная модификация, существует в интервале 1392─1539ºС;  ― низкотемпературная модификация, существует ниже 911ºС;
― низкотемпературная модификация, существует ниже 911ºС;  ─ существует в интервале 911 ─ 1392ºС
─ существует в интервале 911 ─ 1392ºС
Устойчивость определенной фазы диктуется более низкой свободной энергией.  ─ Fe имеет ОЦК решетку;
─ Fe имеет ОЦК решетку;  ─ Fe имеет ОЦК решетку;
─ Fe имеет ОЦК решетку;  ─ Fe имеет ГЦК решетку.
─ Fe имеет ГЦК решетку.

Рисунок 1. Связь свободной энергии с типом кристаллической решетки железа
 -Fe ─период решетки 2,8606
-Fe ─период решетки 2,8606  ; до температуры 768ºС ─ ферромагнитно (магнитного). Точка перехода из ферромагнитного в парамагнитное состояние называют точкой Кюри (обозначают А2).
; до температуры 768ºС ─ ферромагнитно (магнитного). Точка перехода из ферромагнитного в парамагнитное состояние называют точкой Кюри (обозначают А2).
|
|
|
Плотность железа:  = 7,68 г./см3. Структура
= 7,68 г./см3. Структура  и
и  ─ Fe:
─ Fe:

 -Fe ─парамагнитно. Зерна
-Fe ─парамагнитно. Зерна  -Fe имеют ограненные края с наличием двойников:
-Fe имеют ограненные края с наличием двойников:

 = 8,0–8,1 г/см3
= 8,0–8,1 г/см3
Точка перехода  в
в  -Fe (I полиморфное превращение) обозначается А3=911ºС.
-Fe (I полиморфное превращение) обозначается А3=911ºС.
Точка перехода  в
в  -Fe (II полиморфное превращение) обозначается А4=1392ºС.
-Fe (II полиморфное превращение) обозначается А4=1392ºС.

Рисунок 2. Кривая охлаждения чистого железа
В железе существует металлический (межатомный) тип связи. Железо является переходным металлом (не достроенная S – оболочка, достраивается d – оболочка).
Углерод (С) имеет две модификации: графит и алмаз и может быть в аморфном состоянии. Является неметаллическим (точнее полуметаллическим) материалом. Атомный номер N = 6, плотность  = 2,5 г/см3, атомная масса 12,011, температура плавления 3500º С, атомный радиус 0,77
= 2,5 г/см3, атомная масса 12,011, температура плавления 3500º С, атомный радиус 0,77  . Графит ─ имеет слоистую гексагональную решетку. Межатомное расстояние небольшое и составляет 1,4
. Графит ─ имеет слоистую гексагональную решетку. Межатомное расстояние небольшое и составляет 1,4  ; расстояние между плоскостями 3,4
; расстояние между плоскостями 3,4  . В слоях действуют сильные ковалентные связи, а между слоями слабые силы Ван дер Ваальса. (В ковалентной связи силы равняются 700 кДж/г-атом. В силах Ван дер Ваальса ─ 4
. В слоях действуют сильные ковалентные связи, а между слоями слабые силы Ван дер Ваальса. (В ковалентной связи силы равняются 700 кДж/г-атом. В силах Ван дер Ваальса ─ 4  9 кДж/г-атом).
9 кДж/г-атом).
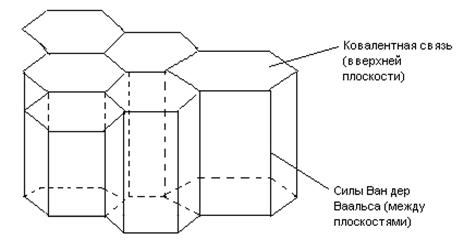
Рисунок 3. Силы связи в кристаллической решетке углерода
Графит – мягок, обладает высокой электропроводностью, непрозрачен и имеет металлический блеск. В алмазной модификации – существуют только ковалентные связи. Алмаз – самый твердый материал, по нему сравнивают другие элементы и твердые сплавы (в г. Алмазное производят углеродистую сажу).
Фазы в железоуглеродистых сплавах
В системе Fe─C различают следующие фазы: жидкий сплав, твердые растворы внедрения, химическое соединения, чистые компоненты (графит).
Твердые растворы:
Феррит (Ф) ─ различают  ─ Ф и
─ Ф и  ─ Ф
─ Ф
 ─ Ф ─ твердый раствор внедрения углерода в
─ Ф ─ твердый раствор внедрения углерода в  ─ Fe (высокотемпературном). Предельная растворимость углерода 0,1%.
─ Fe (высокотемпературном). Предельная растворимость углерода 0,1%.
 ─ Ф ─ твердый раствор внедрения углерода в
─ Ф ─ твердый раствор внедрения углерода в  ─ Fe (низкотемпературном). Предельная растворимость углерода 0,025% при температуре 727º С. При комнатной температуре феррит растворяет только 0,006% С.
─ Fe (низкотемпературном). Предельная растворимость углерода 0,025% при температуре 727º С. При комнатной температуре феррит растворяет только 0,006% С.
|
|
|
Атом углерода располагается в решетке феррита в центре грани куба, где помещается сфера радиусом 0,29R (радиуса атома железа), а также в вакансиях, и дислокациях и т.д.

Рисунок 4. Внедрение атома углерода в решетку феррита
Аустенит (А) ─ твердый раствор внедрения углерода в  ─ Fe. Предельная растворимость углерода ─ 2,14% при температуре 1147º С. Атом углерода в решетке
─ Fe. Предельная растворимость углерода ─ 2,14% при температуре 1147º С. Атом углерода в решетке  ─ Fe располагается в центре элементарной ячейки в которой может поместиться сфера радиусом 0,41R. ГЦК решетка может растворить углерода больше, чем ОЦК.
─ Fe располагается в центре элементарной ячейки в которой может поместиться сфера радиусом 0,41R. ГЦК решетка может растворить углерода больше, чем ОЦК.

Рисунок 5. Внедрение атома углерода в решетку аустенита
Механические свойства.
Феррит:
 =250 н/мм2 (МПа)
=250 н/мм2 (МПа)
 = 120 н/мм2 (МПа)
= 120 н/мм2 (МПа)
 =50%,
=50%,  = 80%
= 80%
НВ 80–90
Аустенит: обладает высокой пластичностью, низкими пределами текучести и прочности.
Пояснения к определению механических свойств.

Данный вопрос рассматривался по дисциплине сопротивление материалов:
Предел прочности:
 =Pмах/F0 (Н/мм2)
=Pмах/F0 (Н/мм2)
Предел текучести:
 = Pt/F0 (Н/мм2)
= Pt/F0 (Н/мм2)
F0 ─ начальная площадь сечения образца (берут F0, т. к. в течении опыта в процессе деформации сечения изменяется).
Относительное удлинение:
 =
= 
Относительное сужение:
Y = 
Твердость (НВ, HRC, HV)─ сопротивление металла небольшим пластическим деформациям.

Рисунок 6. Кристаллическая решетка цементита
Цементит (Ц) ─ химическое соединение железа с углеродом ─ карбид железа Fe3C. В цементите содержится 6,67% С. Цементит имеет сложную ромбическую решетку с плотной упаковкой атомов (рис. 6). Температура плавления цементита ─ 1250º С. Магнитные свойства цементит теряет при 217ºС. Имеет высокую твердость: > 800 НВ, но очень низкую, нулевую пластичность. Цементит ─ соединение неустойчивое и при определенных условиях распадается с образованием свободного углерода в виде графита.
|
|
|


