 |
Каждая L- и Н-цепь кодируется более чем одним генным сегментом
|
|
|
|
Участие необычных генетических механизмов в образовании антител стало очевидным задолго до того, как стало ясно, какой вклад вносят эти механизмы в разнообразие антиген-связывающих участков. Как уже говорилось изучение аминокислотных последовательностей миеломных белков показало, что каждая цепь иммуноглобулина состоит из вариабельной (V) и константной (С) областей, и тогда возник вопрос: как такие цепи кодируются в геноме? Уже в то время предполагали, что V- и С-области каждой из цепей могут кодироваться двумя отдельными генами, которые каким-то образом соединяются перед экспрессией.
Первые прямые данные о перестройке ДНК в процессе развития В-клеток были получены в 1976 г. в экспериментах, в которых ДНК из ранних мышиных эмбрионов, неспособных к выработке антител, сравнивали с ДНК из клеток мышиной миеломы, вырабатывающих антитела. Эти два вида ДНК переваривали рестрикционной нуклеазой и полученные фрагменты гибридизо-вали с радиоактивными последовательностями ДНК, приготовленными путем копирования in vitro V- или С-последовательности молекул информационной РНК для L-цепей, выделенной из клеток миеломы. Как показали результаты этих опытов, специфические V- и С-кодирующие последовательности находились у эмбрионов в разных рестрикционных фрагментах ДНК, а в клетках миеломы – в одном и том же рестрикционном фрагменте. Таким образом, у зародыша, где гены иммуноглобулинов не экспрессируются, последовательности ДНК, кодирующие V- и С-области той или иной цепи, локализуются в различных участках генома; между тем в клетке миеломы, где уже образуются цепи иммуноглобулинов, эти две последовательности соединены вместе.
Сейчас известно, что для каждого типа цепей иммуноглобулинов –легких цепей х, легких цепей λ и тяжелых цепей – существует отдельный «пул» (обширная группа) генов, которые могут быть использованы при синтезе каждой отдельной полипептидной цепи. Каждый такой пул содержит набор различных V-генов, расположенных на сотни тысяч нуклеотидов «выше» (т.е. ближе к 5'-концу кодирующей цепи ДНК) одного или нескольких С- генов. В процессе развития В-клеток любой из V-генов может быть транслоцирован таким образом, что он окажется рядом с определенным С-геном. Тогда, после того как произойдет такая перестройка ДНК, может синтезироваться цепь иммуноглобулина.
|
|
|
Пулы генов, кодирующие х-, λ- и Н-цепи, находятся в разных хромосомах. У мыши пул генов х в хромосоме 6 содержит один С-ген (Сх) и большой набор V-генов (Vxl, VX2, VX3...). Пул генов λ, в хромосоме 16 содержит только два V-гена (Vλl и Vλ2), каждый из которых ассоциирован с одним или двумя разными С-генами С λ. Пул тяжелых цепей, находящийся в хромосоме 12, содержит большой набор V-генов (Vh) и упорядоченную группу различных С-генов, каждый из которых кодирует отдельный класс тяжелых цепей (Сα, Сβ,Сε и Сλ) (рис. 17-40). В случае тяжелой цепи первоначальная транслокация Vн-гена всегда переносит его близко к Сμ-гену, поэтому первым антителом, синтезируемым развивающейся В-клеткой, всегда оказывается молекула IgM.
На самом деле эти пулы генов сложнее, чем показано на рис. 17-40. Вместо того чтобы кодироваться одним-единственным V-геном, как предполагалось вначале, каждая V-область полипептидной цепи кодируется двумя или тремя отдельными генными сегментами, которые объединяются в функциональный V-ген только тогда, когда происходит перестройка ДНК, соединяющая вместе V- и С-кодирующие области. Как мы увидим, такое объединение различных V-сегментов, приводящее к образованию гена V-области, непосредственно увеличивает разнообразие антиген-связывающих участков.
|
|
|
V-область каждой L-цепи кодируется двумя генными сегментами
То, что V-области кодируются более чем одним генным сегментом, установлено в 1978 г., когда был закончен первый анализ нуклеотидной последовательности одного из генов иммуноглобулиновгена Vλ, выделенного из эмбриона мыши. Вместо того чтобы кодировать все 110 аминокислот Vλ-области, ген Vλ кодировал только 97 N-концевых аминокислот. Оказалось, что оставшиеся 13 аминокислот этой области кодируются отдельным сегментом ДНК, расположенным на сотни тысяч нуклеотидов дальше и получившим название соединительного или Jλ-сегмента (не путать с боковой J-цепью, которая кодируется в другой части генома). Jλ-сегмент всегда примыкает к Сλ,-гену, от которого он отделен интроном. В ходе развития В-клетки Vλ-ген (который мы будем далее называть Vλ-сегментом), поскольку он кодирует лишь часть Vλ-области полипептидной цепи, транслоцируется таким образом, что оказывается рядом с Jλ-сегментом, так что в ДНК получается последовательность Vλ-Jλ-интрон-Сλ. Эта последовательность транскрибируется в молекулы РНК, из которых интроны после удаляются, так что после сплайсинга образуются молекулы мРНК с примыкающими друг к другу последовательностями V, J и С. Именно эти молекулы мРНК транслируются в полипептиды легких цепей.
Впоследствии было установлено, что у мышей имеется несколько разных J-сегментов в каждом пуле генов для иммуноглобулинов: по одному ассоциировано с каждым С-геном в генном пуле λ-цепей и по четыре – в генных пулах х- и Н-цепей (каждый С-ген отделен от соседнего с ним J-сегмента интроном). В период развития В-клеток в генных пулах х- и Н-цепей любой V-сегмент может объединиться с любым J-сегментом, что увеличивает в четыре раза число V-областей, которые эти пулы могут производить. Кроме того, существуют некоторые различия в точном месте соединения V-J, и это приводит к еще большему разнообразию аминокислотных последовательностей. Существенно то, что сайт соединения V-J кодирует часть третьей гипервариабельной области легкой цепи.
После соединения V и J все «лишние» J-сегменты «ниже» присоединенного J-сегмента транскрибируются, а затем их последовательности, так же как и последовательности интронов, вырезаются из РНК-транскрипта (рис. 6). Появляется все больше данных в пользу того, что соединение тех или иных V- и J-сегментов ДНК в процессе развития В-лимфоцитов сопровождается элиминацией всей лежащей между ними ДНК (см. рис. 6). Конкретный механизм соединения сегментов, которые могут быть удалены друг от друга на сотни тысяч нуклеотидов, остается загадкой. Однако обнаружены специфические, весьма консервативные последовательности ДНК, примыкающие «снизу» к V-сегментам и «сверху» к J-сегментам.
|
|
|

Рисунок 6. Процесс соединения V - J, с которым связано образование х-легкой цепи у мыши.
Предполагается, что они могут служить сайтами узнавания для ферментов сайт-специфической комбинации ДНК (рис. 7), но такого рода ферменты пока не идентифированы.
V -область каждой Н-цепи кодируют три генных сегмента
Сборка гена, кодирующего вариабельную область тяжелой (Vh) цепи процесс еще более сложный, чем сборка гена вариабельной легкой цепи (Vl). Здесь тоже участвует J-сегмент, однако в дополнение к нему некоторые аминокислоты третьего гипервариабельного участка V-области кодируются еще одним генным сегментом, получившим название D-сегмента (diversity gene segment). Число различных D-сегментов неизвестно, но у мыши их не менее десятка. В результате серии сайт-специфических перекомбинаций D-сегмент соединяется с каким-либо из Vн или с каким-либо из Jн-сегментов, что приводит к созданию функционального Vн-гена. Существование отдельных D-сегментов еще по меньшей мере в 10 раз увеличивает число различных Vн-областей, которые могут образоваться у мыши.
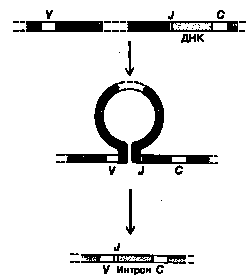
Рисунок 7. Схема, иллюстрирующая возможную роль специфических последовательностей ДНК (показаны цветными), расположенных «ниже» V -сегмента и «выше» J -сегмента, в соединении V - J. Взаимодействие между этими последовательностями, вероятно, происходит при участии сайт-специфической рекомбинационной системы, катализирующей разрыв и воссоединение двойных спиралей ДНК в области этих последовательностей.
|
|
|
Разнообразие антител увеличивается благодаря соматической рекомбинации, соединению легких и тяжелых цепей в различных сочетаниях и возникновению соматических мутаций. В процессе эволюции иммунной системы выработался целый ряд различных механизмов, приводящих к большому разнообразию антиген-связывающих участков антител. Только часть из этих механизмов связана с описан выше соматическими перестройками ДНК в ходе развития В-лимфоцитов. Эксперименты по подсчету числа генов с использованием метода гибридизации ДНК показывают, что в геноме мыши, видимо, содержится несколько сотен Vх-сегментов, сходное число Vн-сегментов и два Vλ-сегмента. Из этого можно вычислить, что путем комбинированы личных унаследованных V-, D- и J-сегментов у мыши может образоваться по меньшей мере 10000 разных Vн-областей и 1000 разных VL-областей.
Один простой, но весьма важный механизм, сильно увеличивающий разнообразие антител, состоит в комбинировании различных L- и Н-цепей. Поскольку в антиген-связывающий участок антитела вносят вклад как L-, так и Н-цепи, у животного с 1000 генов, кодирующих Vl-o6ласти, и с 10000 генов, кодирующих Vн-области, продукты этих генов могли бы образовать 1000 х 1000 различных комбинаций, т.е. 107 разных антиген-связывающих участков, если предположить, что при этом любая L-цепь может сочетаться с любой Н-цепью.
Недавно было показано, что в генах V-области и поблизости от них происходят соматические мутации; вероятно, это увеличивает число разных антител по крайней мере в 10-100 раз. Механизмы, благодаря которым мутации возникают именно здесь, неизвестны. Однако было обнаружено, что мутации встречаются гораздо чаще в антителах IgG и IgA, чем в кодируемых Vн-геном антителах IgM. Это, пожалуй, неудивительно, так как молекулы IgM вырабатываются на ранних стадиях иммунного ответа, a IgG и IgА появляются относительно поздно. Поэтому В-клетки, переключившиеся на IgG или IgA, как правило, претерпели большее число делений, чем В-клетки, продолжающие вырабатывать IgM, и поэтому, скорее всего, накопили больше мутаций. С другой стороны, может существовать механизм, повышающий частоту мутирования V-генов после того, как произойдет переключение с IgM на иммуноглобулины других классов. Как бы было, изменение антиген-связывающих участков в результате соматических мутаций может вести к тому, что антиген будет особенно эффективно вызывать пролиферацию тех В-клеток, у которых измененные антитела приобрели высокое сродство к антигену; возможно, что именно этим (по крайней мере отчасти) объясняется повышение сродства антител, наблюдаемое после иммунизации (созревание сродства). Таким образом, соматические мутации могут не только увеличивать разнообразие антител, но и служить для тонкой подстройки антител при иммунном ответе.
|
|
|
Механизмы экспрессии генов антител обеспечивают моноспецифичность В-клеток
Теория клональной селекции предсказала, а разнообразные эксперименты подтвердили, что отдельные В-клетки моноспецифичны, т.е. вырабатывают антитела с антиген-связывающим участком только одного типа. Значит, должен существовать какой-то механизм, ограничивающий возможности активации иммуноглобулиновых генов в индивидуальных В-клетках, так что эти клетки могут вырабатывать только один тип L-цепи и один тип Н-цепи. Например, В-клетка не может одновременно производить легкие цепи х и λ, и поддерживать при этом моноспецифичность, так как эти две цепи почти всегда имели бы разные вариабельные области и потому образовывали бы молекулы антител с антиген-связывающими участками более чем одного вида. Действительно, в каждой В-клетке активируется либо один, либо другой из этих генных пулов, но никогда не активируются оба пула одновременно.
Более того, поскольку В-клетки (как все соматические клетки) диплоидны, каждая из них имеет шесть генных пулов, кодирующих антитела: по одному пулу для Н-цепи, для λ-цепи и для х-цепи от каждого из родителей. Моноспецифичность В-клеток означает, что в каждой клетке должны активироваться гены только двух из этих шести пулов – один из четырех генных пулов легких цепей и один из двух генных пулов тяжелых цепей. Таким образом, В-клетка должна делать выбор не только между х и λ, но также и между материнскими и отцовскими генными пулами. Экспрессия только материнского или только отцовского аллеля гена Ig в любой данной В-клетке называется аллельным исключением. Материнские и отцовские аутосомные гены для других белков экспрессируются в клетке приблизительно одинаково. У позвоночных из этой закономерности выпадает (кроме генов иммуноглобулинов) только инактивация одной из двух Х-хромосом у самок.
Почему важно, чтобы В-клетки были моноспецифичны? Моноспецифичность гарантирует, что каждая молекула антитела будет составлена из двух идентичных половинок и поэтому будет содержать два идентичных антиген-связывающих участка. По-видимому, это свойство выработалось в процессе эволюции потому, что оно наделяет антитела способностью образовывать обширные сети из сшитых антигенов. Механизмы, участвующие в аллельном исключении и в выборе одного типа L-цепей в ходе развития В-клеток, неизвестны. Одна из очевидных возможностей состоит в том, что в неэкспрессируемых генных пулах сегменты генов антител просто не подвергаются перегруппировке. Однако уже получены убедительные данные о том, что это не так. Часто в неэкспрессируемых хромосомах перестройки происходят, но неправильным образом и поэтому не могут обеспечить синтез цепей Ig, пригодных для построения антител. Это наводит на мысль, что, может быть, соединение сегментов генов V-области в ходе развития В-клеток – в известной степени случайный процесс, чаще приводящий к непродуктивным перестройкам, чем к продуктивным. В этом случае аллельное исключение могло бы быть просто результатом того, что очень низка вероятность успешной перестройки в более чем одном генном пуле для каждой цепи. Но это означало бы, что во многих клетках вообще не будет успешной перестройки и, следовательно, синтеза антител. Поскольку такие клетки не будут стимулироваться никаким антигеном, они должны быстро погибать. Подобный механизм представляется весьма расточительным, однако это может быть расплатой за моноспецифичность.
Переключение синтеза с мембраносвязанной на секретируемую форму одного и того же антитела происходит путем изменения РНК-транскриптов для Н‑цепи
Рассмотрев генетические механизмы, от которых зависит структура антиген- связывающего участка, мы перейдем теперь к механизмам, определяющим биологические свойства антитела, т. е. тип константной области тяжелой ветви. Если однажды сделанный выбор определенных сегментов ДНК для кодирования антиген-связывающего участка является окончательным и для В-клетки, и для ее потомков, то тип синтезируемой Сн-области может изме- няться в процессе развития клетки.
Антитела всех классов могут синтезироваться как в мембраносвязанной, так и в растворимой, секретируемой Мембрано-связанные антитела служат рецепторами для антигена на поверхности В-клеток. После стимуляции клетки антигеном те же самые антитела вырабатываются в секретируемой форме. В случае IgM эти две формы разли- чаются только С-концевым участком μ-цепи: у мембраносвязанных антител μ -цепь оканчивается гидрофобным участком, закрепляющим ее в липидном бислое плазматической мембраны В-клетки, тогда как у секретируемых анти- тел IgM имеется вместо этого гидрофильный «хвост», позволяющий молеку- лам выходить из клетки. Способность В-клеток производить μ-цепи с константными областями двух различных типов сначала казалась парадоксальной, так как В-клетки содержат лишь одну копию гена С„ на гаплоидный геном.
Парадокс был разрешен, когда выяснилось, что активация В-клеток приводит к изменению ядерных РНК-транскриптов для μ-цепи: эти транскрипты несколько короче тех, которые кодировали мембраносвязанную μ-цепь.
В-клетки могут переключаться с выработки одного класса антител на выработку другого
Переключение синтеза с мембраносвязанной формы антител на секретируемую форму – не единственный вид изменений, которые могут происходить в С-области тяжелой цепи в ходе развития В-клеток. Все В-клетки начинают свою деятельность по синтезу антител с выработки IgM, но многие из них затем переключаются на выработку антител других классов, например IgG или IgA. Этот процесс называют переключением класса. Способность В-клеток изменять вырабатываемый ими класс антител без изменения антиген-связывающего участка означает, что один и тот же собранный Vн-ген может последовательно ассоциироваться с разными Сн-генами.
По-видимому, процесс переключения класса состоит из двух последовательных этапов. Сначала клетка, производящая мембраносвязанный IgM, может переключиться на одновременную выработку мембраносвязанного IgM и мембраносвязанной формы антител другого класса, например IgD. Как полагают, такая В-клетка продуцирует длинные первичные РНК-транскрипты, содержащие наряду с собранной последовательностью Vн-области как Сμ, так и Сδ-последовательности. Такие транскрипты подвергаются затем сплайсингу двумя различными способами, приводящими к двум разным видам молекул мРНК. Оба вида кодируют одну и ту же Vн-область, но один вид содержит Сμ-, а другой - Сδ-последовательность. Вероятно, тот же механизм действует при переключении В-клетки на одновременную выработку мембраносвязанных форм IgM и одного из других классов антител-IgG, IgE или IgA.
Второй этап происходит тогда, когда В-клетка, одновременно вырабатывающая мембраносвязанные антитела класса IgM и какого-то второго класса, стимулируется антигеном и начинает уже секретировать антитела этого второго класса. Этот этап включает делецию ДНК. Например, клетка, синтезировавшая мембраносвязанные IgM и IgA в результате сплайсинга длинного РНК-транскрипта, содержавшего все последовательности Сн-генов и собранную последовательность Vн-генов со структурой VH2-D1-JH3, может начать секретировать IgA в результате делеции большей части ДНК между Jh3 и Са, включавшей гены Сμ, Сδ, Сγ и Сε. Доказательство того, что этот этап переключения класса включает делецию ДНК, было получено в опытах с клетками миеломы: оказалось, что клетки, секретирующие IgG, не содержат ДНК, кодирующей Сμ и Cδ, а клетки, выделяющие IgA, не содержат ДНК, кодирующей константные области тяжелых цепей всех остальных классов.
Способность любого собранного Vн-гена ассоциироваться с любым из Сн-генов имеет важный функциональный смысл: благодаря этой способности определенный антиген-связывающий участок, отобранный антигенами окружающей среды, может у данной особи быть распределен по всем классам иммуноглобулинов и может, таким образом, приобрести все биологические свойства, характерные для каждого из классов.
Список литературы
1. Структура и функции антител // Под. ред. Л. Глинна, М. Стьюарда. Пер. с англ., М.: Мир, 1983, 200 с.
2. Албертс Б., Брей Д., Льюис Д., Рэфф М., Робертс К., Уотсон. Д. Молекулярная биология клетки. – М., Мир, 1987. Т 5, 336 с.
3. Кульберг А.Я. Молекулярная иммуннология. – М.: ВШ, 1985. 288 с.
4. Нелезин Р.С. Строение и биосинтез антител. – М.: Наука, 1972. 312 с.
5. Марри Р., Греннер Д., Мейерс П., Родуэл В. Биохимия человека. – M., Мир, 1993. –Т 2, 416 с.
6. Молекулярная клиническая диагностика. Методы. / Под. ред. Херрингтона С. Пер. с англ. – М.: Мир, 1999. 560 с.
7. Lo Y. et. al. Detection of single-copy fetal DNA sequence from maternal blood. Lancet, 335, 1463
|
|
|
12 |


