 |
XXXXVI Всероссийская олимпиада школьников по химии
|
|
|
|
III (региональный) этап 2010 г.
Теоретический тур
ОДИННАДЦАТЫЙ КЛАСС
Задача 11-1
Некоторое белое кристаллическое вещество А при нагревании на воздухе испытывает ряд превращений, последовательно образуя белые кристаллические вещества Б – Г. Навеску 5 г вещества А последовательно нагревали до температур, соответствующих полному превращению в соединения Б, В и Г, после чего определяли массу образца. Результаты экспериментов суммированы в таблице.
| Температура, K | Вещество | Масса образца, г | Реакция |
| А | 5,0000 | ||
| Б | 4,3475 | ||
| В | 4,0213 | ||
| Г | 2,5717 |
В другом эксперименте образцы А – Г массой по 5 г каждый растворяли в 95 г воды и определяли рН полученных растворов. Оказалось, что растворы А – В имеют рН около 2,5, тогда как раствор Г нейтрален.
Вопросы.
1. Определите вещества А – Г и напишите уравнения реакций, последовательно происходящих при нагревании вещества А.
2. Объясните, почему величина рН водного раствора Г существенно отличается от величин рН растворов А – В.
3. Что будет происходить с соединением Г при дальнейшем нагревании?
4. Каково геометрическое строение структурных единиц, из которых построены вещества А и В?
5. Где может использоваться соединение А?
Задача 11-2
И, изменив свою окраску,
Пустились в пляску, колдовские.
Леонид Мартынов
На схеме представлены превращения соединений, содержащих переходный металл Х.

Известно, что:
1) А (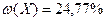 ) кристаллизуется из водного раствора Е и содержит 15,13 % кристаллизационной воды;
) кристаллизуется из водного раствора Е и содержит 15,13 % кристаллизационной воды;
2) при добавлении к раствору, содержащему 8,29 г А, избытка раствора AgNO3 выпадает 10 г белого осадка;
3) вещество С содержит 35, 51 % Х по массе.
4) переходный металл Х присутствует в малых концентрациях в минералах никелин и купферникель.
|
|
|
Вопросы.
1. Определите Х и соединения А – Е. Ответ подтвердите расчётом.
2. Объясните геометрическое строение веществ А и С.
3. Предположите цвета соединений А и E.
4. Напишите ещё 2 способа получения безводной соли Е (укажите условия реакций).
5. Напишите реакции взаимодействия:
a) металла Х с монооксидом углерода;
b) соли Е с водным раствором аммиака и хлорида аммония на воздухе (NH3 + NH4Cl + O2), если при этом образуется вещество с массовой долей азота 27,94 %;
c) соли Е с водным раствором аммиака и хлорида аммония на воздухе (NH3 + NH4Cl + O2) в присутствии активированного угля, если при этом образуется вещество с массовой долей азота 31,40 %.
Задача 11-3
На приведённой ниже схеме превращений зашифрованы важные промышленные процессы, используемые для получения различных мономеров.
1. Расшифруйте эту схему, учитывая, что на ней отсутствуют коэффициенты.
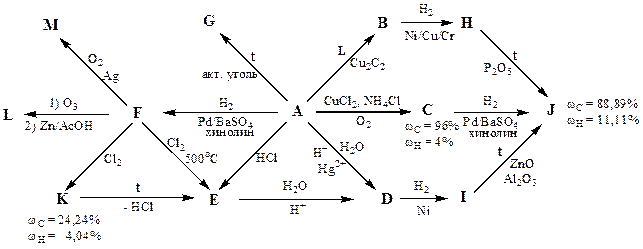
2. Напишите структуры повторяющихся звеньев полимеров, образующихся при полимеризации соединений E, F, M.
Соединения A и J в зависимости от условий полимеризации могут образовывать по два типа регулярных полимеров.
3. Напишите структуры повторяющихся звеньев для каждого из них.
Задача 11-4
17 ноября 2009 г. исполнилось 160 лет со дня рождения великого русского химика Е. Е. Вагнера. Его магистерская диссертация была связана с изучением окисления кетонов хромовой смесью при 100 °С. Он нашёл, что в этих условиях гексанон-3 превращается в смесь трёх кислот в соотношении 1: 1: 1.
1. Напишите структурные формулы образовавшихся кислот и соответствующие уравнения реакций.
2. Укажите, какая из написанных Вами реакций протекает быстрее.
При изучении окисления несимметричных кетонов Вагнер установил, что «При неодинаково гидрогенизированных прикарбонильных атомах углерода окисляется и отщепляется при главном направлении реакции тот из них, который … гидрогенизирован, при второстепенном направлении, наоборот, – … гидрогенизированный.»
|
|
|
3. Вставьте пропущенные слова «более» и «менее» в правило, сформулированное Вагнером. Учтите, что сейчас, в отличие от Вагнера, мы знаем, что эта реакция начинается с превращения кетонов в изомерные им енолы, что позволяет предсказывать направление реакции на основании правила А. М. Зайцева, учителя Вагнера в Казанском университете.
При изучении реакции окисления изопропилэтилкетона Вагнер нашёл, что скорость «главной» реакции в 4 раза превышает скорость «второстепенной».
4. Укажите соотношение (по массе) кислот, образующихся в ходе этого процесса.
5. Тем не менее, есть примеры соединений, на которые данное правило не распространяется. Среди приведённых ниже соединений выберите те, для которых правило Вагнера не выполняется. Объясните Ваш выбор.
Список соединений: 2,3,6-триметилгептанон-4, 3-метил-1-фенилбутанон-2, 4-метил-1-фенилпентанон-3, 2,2-диметилпентанон-3.
Задача 11-5
Зависимость скорости химической реакции от температуры.
Связь уравнений Вант-Гоффа и Аррениуса
Скорость большинства химических реакций увеличивается с ростом температуры. Для описания зависимости скорости химической реакции от температуры используют различные соотношения.
Одно из таких соотношений – эмпирическое правило Вант-Гоффа, согласно которому при увеличении температуры на 10 градусов скорость гомогенной реакции возрастает в 2 ÷ 4 раза, т. е. температурный коэффициент скорости реакции g равен
 .
.
Другое из таких соотношений – уравнение Аррениуса, согласно которому константа скорости реакции описывается следующей формулой:
 ,
,
или в логарифмической форме
 ,
,
в которой E A – энергия активации реакции, A – постоянная, не зависящая от температуры.
Вопросы.
1. Подставив уравнение Аррениуса в правило Вант-Гоффа, получите уравнение, связывающее энергию активации реакциии температурный коэффициент скорости.
2. Используя полученное соотношение, рассчитайте диапазон энергий активации, в котором правило Вант-Гоффа выполняется при температурах, близких к комнатной.
3. Покажите, как этот диапазон зависит от температуры. Для этого с помощью полученного соотношения изобразите на одном графике зависимости E A от температуры (в интервале от 0 до 500 К) для g = 2 и g = 4.
|
|
|
XLVII Всероссийская олимпиада школьников по химии
III (региональный) этап. Кировская область, 1 февраля 2011 года.
__________________________________________________________________________________________________
Одиннадцатый класс
Задача 11-1
Для приготовления пирофорного нанопорошка металла юный химик использовал твёрдую двухосновную кислоту А, содержащую 32 % углерода и бесцветный порошок Б (содержит 4,5 % углерода), разлагающийся кислотой с выделением газа, имеющего плотность при н. у. 1,97 г/л. В результате реакции был получен раствор, из которого со временем выделились кристаллы вещества С. Они бесцветны, растворимы в воде, а их раствор даёт чёрный осадок под действием сероводорода и коричневый – под действием раствора гипохлорита натрия. Чёрный осадок при действии пероксида водорода становится белым. При нагревании вещества В до 400 °C в вакууме был получен нанопорошок металла Г с размером частиц 50 нм. На воздухе порошок самораскаляется, постепенно превращаясь в красно-коричневый порошок Д, содержащий 7,17 % кислорода.
Вопросы.
1. Назовите неизвестные вещества и запишите уравнения реакций.
2. Приведите два примера получения пирофорных порошков других металлов.
Задача 11-2
В водах мирового океана содержится 4,5 миллиарда тонн урана в виде уранил-иона  . Это примерно в 820 раз больше, чем можно извлечь из всех известных месторождений урановой руды, из которой этот металл сегодня добывается для использования в ядерных реакторах. Однако в виду низкой концентрации и специфической формы уранил-иона, его экономически выгодное извлечение из морской воды известными химическими методами до недавнего времени считалось практически невозможным.
. Это примерно в 820 раз больше, чем можно извлечь из всех известных месторождений урановой руды, из которой этот металл сегодня добывается для использования в ядерных реакторах. Однако в виду низкой концентрации и специфической формы уранил-иона, его экономически выгодное извлечение из морской воды известными химическими методами до недавнего времени считалось практически невозможным.
В 2010 году американские учёные предложили использовать для этого
2,6-терфенилкарбоксилат ион, который селективно координирует уранил-ион, образуя устойчивый, малорастворимый в воде комплекс. Объёмные фенильные группы закрывают уранил-ион в виде капсулы, таким образом, вытесняя воду из внутренней сферы и усиливая прочность комплекса:
|
|
|

Схема реакции
Полученный комплекс можно экстрагировать из водного раствора хлороформом. Эксперименты показали, что при достижении фазового равновесия концентрация комплекса в органической фазе в 40 раз выше, чем в водной.
При обработке органического экстракта разбавленным раствором азотной кислоты комплекс разрушается, и уранил-ион переходит в водную фазу. После добавления основания к полученному раствору (для нейтрализации избытка азотной кислоты и создания слабо-щелочной среды) его можно снова экстрагировать. Повторяя эту серию процедур несколько раз, можно добиться значительного концентрирования урана в воде.
Вопросы.
1. Из каких двух основных изотопов состоит природный уран? Какой из них участвует в ядерной реакции на ядерных электростанциях? Что такое обогащённый уран?
2. Напишите сокращённые ионные уравнения реакций образования комплекса и его разрушения раствором азотной кислоты. Для каждого продукта и участника реакции укажите фазу, в которой он находится («о» для органической фазы, «в» – для водной). 2,6-терфенилкарбоновую кислоту и соответствующий ей лиганд можно обозначить RCOOH и RCOO– соответственно. Считайте, что в качестве основания использовался аммиак.
3. Рассчитайте молярную концентрацию уранил-иона в морской воде, учитывая, что объём вод мирового океана составляет 1,3 млрд. кубических километров. Сколько раз необходимо повторить цикл концентрирования исходной морской воды, чтобы достичь концентрации уранил-иона не менее 0,5 моль/л? При решении используйте следующие данные: (1) при экстракции урана из водной фазы объём органической фазы в 10 раз меньше объёма морской воды; (2) при обратной экстракции урана в водную фазу объём раствора азотной кислоты в 10 раз меньше объёма органической фазы; (3) нейтрализация избытка разбавленной азотной кислоты и создание щелочной среды достигаются пропусканием газообразного аммиака через раствор, при этом увеличением объёма раствора можно пренебречь.
4. Потребление урана в мире составляет около 65 тыс. тонн в год. Через сколько лет следует ожидать истощения месторождений урановой руды? Предполагая, что после этого уран будет добываться из океана, и что скорость потребления останется неизменной, оцените количество воды, которое нужно будет перерабатывать в мире ежедневно, чтобы удовлетворить потребность в уране.
Задача 11-3
Вещество Х представляет собой бесцветные игольчатые кристаллы с резким запахом, постепенно розовеющие на воздухе. Оно умеренно растворимо в воде (6,5 г на 100 г воды), гораздо лучше в растворах щелочей. Х растворим также в этаноле, хлороформе, бензоле. Водный раствор X используется как антисептическое средство, для дезинфекции предметов домашнего и больничного обихода.
|
|
|
Вещество Х может быть получено из бензолсульфоновой кислоты (бензолсульфокислоты) сплавлением её натриевой соли с твёрдой щёлочью с последующей обработкой продукта реакции кислотой (реакции 1 и 2). Вещество Х даёт характерную сине-фиолетовую окраску с солями железа (III), например с FeCl3 (реакция 3).
В фармацевтическом анализе для установления подлинности препарата используют реакцию 1 % водного раствора Х с бромной водой, приводящую к образованию белого осадка вещества А (реакция 4). При избытке брома реакция протекает с образованием жёлтого осадка вещества В, содержащего 78 % брома (реакция 5). Вещество В не даёт характерной окраски с хлоридом железа (III) и является мягким бромирующим агентом.
В фармацевтическом анализе получила распространение другая методика: 0,5 г Х растворяют в 2 мл NH3 (C = 13,5 M), доводят до метки до 100 мл. К аликвоте 2 мл добавляют 0,05 мл NaClO (ω(Cl) = 0,03) и оставляют раствор при комнатной температуре. Постепенно появляется тёмно-синее окрашивание (вещество Y).
1. Установите и назовите вещество Х.
2. Напишите уравнения реакций 1 – 5.
3. Напишите уравнения реакций получения Y из Х, если в качестве промежуточных веществ последовательно образуются С и D. Содержание кислорода в C, D, Y составляет 30,2 %, 14,9 % и 16,1 % соответственно. Ответ подтвердите расчётами. Учтите, что в соединении С имеется лишь два типа атомов углерода.
4. Кроме указанного выше метода известно ещё по крайней мере 4 способа получения Х. Укажите один из них. Напишите соответствующее уравнение (или уравнения) реакции.
Задача 11-4
Как известно, основным направлением потребления углеводородов до сих пор является их сжигание. Однако известны и разнообразные примеры частичного окисления углеводородов, приводящего к тем или иным ценным продуктам. При этом в зависимости от используемого окислителя и условий проведения реакции один и тот же углеводород можно превратить в разные соединения. На приведённой схеме показаны наиболее часто используемые методы окисления алкенов на примере (Е)-пентена-2. Учтите, что соединение М содержит 69.8 % углерода, при действии MnO2 оно превращается в продукт N, дающий реакцию серебряного зеркала с образованием соли О; соединения J и L являются диастереомерами (оптическими изомерами, не являющимися зеркальным отображением друг друга), а соединения К и М – изомеры, имеющие разные функциональные группы.

1. Напишите структурные формулы соединений A–O.
2. Напишите уравнение реакции (Е)-пентена-2 с перманганатом калия в растворе серной кислоты.
3. Соединения D, F и H легко превращаются в А, а Е, G и I в В. На примере одного из продуктов реакции (А или В, на ваш выбор) напишите, с помощью каких реагентов можно осуществить эти превращения (один пример для каждого превращения).
Задача 11-5
|
|
|


