 |
Работа газа при изменении его объема
|
|
|
|
Первое начало термодинамики
Рассмотрим термодинамическую систему, для которой механическая энергия не изменяется, а изменяется лишь ее внутренняя энергия. Внутренняя энергия системы может изменяться в результате различных процессов, например совершения над системой работы и сообщения ей теплоты. Так, вдвигая поршень в цилиндр, в котором находится газ, мы сжимаем этот газ, в результате чего его температура повышается, т. е. тем самым изменяется (увеличивается) внутренняя энергия газа. С другой стороны, температуру газа и его внутреннюю энергию можно повысить за счет сообщения ему некоторого количества теплоты — энергии, переданной системе внешними телами путем теплообмена (процесс обмена внутренними энергиями при контакте тел с разными температурами).
Таким образом, можно говорить о двух формах передачи энергии от одних тел к другим: работе и теплоте. Энергия механического движения может превращаться в энергию теплового движения и наоборот. При этих превращениях соблюдается закон сохранения и превращения энергии; применительно к термодинамическим процессам этим законом и является первое начало термодинамики, установленное в результате обобщения многовековых опытных данных.
Допустим, что некоторая система (газ, заключенный в цилиндр под поршнем), обладая внутренней энергией U 1, получила некоторое количество теплоты Q и, перейдя в новое состояние, характеризующееся внутренней энергией U 2, совершила работу А над внешней средой, т. е. против внешних сил. Количество теплоты считается положительным, когда оно подводится к системе, а работа — положительной, когда система совершает ее против внешних сил. Опыт показывает, что в соответствии с законом сохранения энергии при любом способе перехода системы из первого состояния во второе изменение внутренней энергии D U=U 2 -U 1будет одинаковым и равным разности между количеством теплоты Q, полученным системой, и работой А, совершенной системой против внешних сил:
|
|
|
D U=Q-A,
или
Q= D U+A. (51.1)
Уравнение (51.1) выражает первое начало термодинамики: теплота, сообщаемая системе, расходуется на изменение ее внутренней энергии и на совершение ею работы против внешних сил.
Если система периодически возвращается в первоначальное состояние, то изменение ее внутренней энергии DU=0. Тогда, согласно первому началу термодинамики,
A=Q,
т. е. вечный двигатель первого рода — периодически действующий двигатель, который совершал бы большую работу, чем сообщенная ему извне энергия,— невозможен (одна из формулировок первого начала термодинамики).
Работа газа при изменении его объема
Для рассмотрения конкретных процессов найдем в общем виде внешнюю работу, совершаемую газом при изменении его объема. Рассмотрим, например, газ, находящийся под поршнем в цилиндрическом сосуде (рис. 78). Если газ, расширяясь, передвигает поршень на бесконечно малое расстояние d l, то производит над ним работу
dA=Fdl=pSdl=pdV,
где S — площадь поршня, S dl=dV — изменение объема системы. Таким образом,
dA=pdV. (52.1)
Полную работу A, совершаемую газом при изменении его объема от V 1до V 2, найдем интегрированием формулы (52.1):


 Результат интегрирования определяется характером зависимости между давлением и объемом газа. Найденное для работы выражение (52.2) справедливо при любых изменениях объема твердых, жидких и газообразных тел.
Результат интегрирования определяется характером зависимости между давлением и объемом газа. Найденное для работы выражение (52.2) справедливо при любых изменениях объема твердых, жидких и газообразных тел.
Произведенную при том или ином процессе работу можно изобразить графически с помощью кривой в координатах р, V. Например, изменение давления газа при его расширении изобразится кривой на рис. 79. При увеличении объема на dV совершаемая газом работа равна pdV, т. е. определяется площадью полоски с основанием d V на рисунке. Поэтому полная работа, совершаемая газом при расширении от объема V 1до объема V 2, определяется площадью, ограниченной осью абсцисс, кривой p = f(V) и прямыми V1 и V2.
|
|
|
Графически можно изображать только равновесные процессы — процессы, состоящие из последовательности равновесных состояний. Они протекают так, что изменение термодинамических параметров за конечный промежуток времени бесконечно мало. Все реальные процессы неравновесны (они протекают с конечной скоростью), но в ряде случаев неравновесностью реальных процессов можно пренебречь (чем медленнее процесс протекает, тем он ближе к равновесному). В дальнейшем рассматриваемые процессы будем считать равновесными.
Теплоемкость
Удельная теплоемкость вещества величина, равная количеству теплоты, необходимому для нагревания 1 кг вещества на 1 К:

Единица удельной теплоемкости — джоуль на килограмм-кельвин (Дж/(кг•К)).
Молярная теплоемкость— величина, равная количеству теплоты, необходимому для нагревания 1 моля вещества на 1 К:
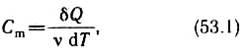
где v = m/M — количество вещества, выражающее число молей.
Единица молярной теплоемкости — джоуль на моль-кельвин (Дж/(моль•К)).
Удельная теплоемкость с связана с молярной Сm соотношением
Ст = сМ, (53.2)
где М — молярная масса вещества.
Различают теплоемкости при постоянном объеме и постоянном давлении, если в процессе нагревания вещества его объем или давление поддерживается постоянным.
Запишем выражение первого начала термодинамики (51.2) для 1 моля газа с учетом формул (52.1) и (53.1):
CmdT = dUm + pdVm. (53.3)
Если газ нагревается при постоянном объеме, то работа внешних сил равна нулю (см. (52.1)) и сообщаемая газу извне теплота идет только на увеличение его внутренней энергии:

т. е. молярная теплоемкость газа при постоянном объеме Сv равна изменению внутренней энергии 1 моля газа при повышении его температуры на 1 К. Согласно формуле (50.1),

тогда
Cv = iR/2. (53.5)
Если газ нагревается при постоянном давлении, то выражение (53.3) можно записать в виде

Учитывая, что dUm/dT не зависит от вида процесса (внутренняя энергия идеального газа не зависит ни от р, ни от V, а определяется лишь температурой Т) и всегда равна Сv (см. (53.4)); продифференцировав уравнение Клапейрона — Менделеева pVm=RT (42.4) по T(p =const), получим
|
|
|
Cp = Cv + R. (53.6)
Выражение (53.6) называется уравнением Майера; оно показывает, что Ср всегда больше Сv на величину молярной газовой постоянной. Это объясняется тем, что при нагревании газа при постоянном давлении требуется еще дополнительное количество теплоты на совершение работы расширения газа, так как постоянство давления обеспечивается увеличением объема газа.
Использовав (53.5), выражение (53.6) можно записать в виде

При рассмотрении термодинамических процессов важно знать характерное для каждого газа отношение Ср к Cv:
g=Cp/Cv=(i+2)/i. (53.8)
Из формул (53.5) и (53.7) следует, что молярные теплоемкости определяются лишь числом степеней свободы и не зависят от температуры. Это утверждение молекулярно-кинетической теории справедливо в довольно широком интервале температур лишь для одноатомных газов. Уже у двухатомных газов число степеней свободы, проявляющееся в теплоемкости, зависит от температуры. Молекула двухатомного газа обладает тремя поступательными, двумя вращательными и одной колебательной степенями свободы.
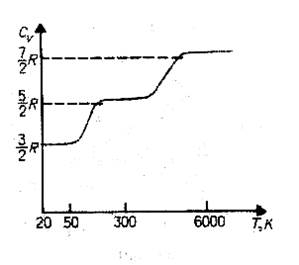 По закону равномерного распределения энергии по степеням свободы, для комнатных температур Cv = 7 / 2 R. Из качественной экспериментальной зависимости молярной теплоемкости Сv водорода (рис. 80) следует, что Cv зависит от температуры: при низкой температуре (»50 К) Cv= 3 / 2 R, при комнатной — Cv= 5 / 2 R (вместо расчетных 7/2 R!) и очень высокой — Сv=7/2/R. Это можно объяснить, предположив, что при низких температурах наблюдается только поступательное движение молекул, при комнатных — добавляется их вращение, а при высоких — к этим двум видам движения добавляются еще колебания молекул.
По закону равномерного распределения энергии по степеням свободы, для комнатных температур Cv = 7 / 2 R. Из качественной экспериментальной зависимости молярной теплоемкости Сv водорода (рис. 80) следует, что Cv зависит от температуры: при низкой температуре (»50 К) Cv= 3 / 2 R, при комнатной — Cv= 5 / 2 R (вместо расчетных 7/2 R!) и очень высокой — Сv=7/2/R. Это можно объяснить, предположив, что при низких температурах наблюдается только поступательное движение молекул, при комнатных — добавляется их вращение, а при высоких — к этим двум видам движения добавляются еще колебания молекул.
Расхождение теории и эксперимента нетрудно объяснить. Дело в том, что при вычислении теплоемкости надо учитывать квантование энергии вращения и колебаний молекул (возможны не любые вращательные и колебательные энергии, а лишь определенный дискретный ряд значений энергий). Если энергия теплового движения недостаточна, например, для возбуждения колебаний, то эти колебания не вносят своего вклада в теплоемкость (соответствующая степень свободы «замораживается» — к ней неприменим закон равнораспределения энергии). Этим объясняется, что теплоемкость моля двухатомного газа — водорода — при комнатной температуре равна 5/2 R вместо 7/2 R. Аналогично можно объяснить уменьшение теплоемкости при низкой температуре («замораживаются» вращательные степени свободы) и увеличение при высокой («возбуждаются» колебательные степени свободы).
|
|
|
|
|
|


