 |
Анализ лекарственных веществ
|
|
|
|
Химические методы анализа
Эти методы используются для установления подлинности лекарственных веществ, испытаний их на чистоту и количественного определения.
Для целей идентификации используют реакции, которые сопровождаются внешним эффектом, например изменением окраски раствора, выделением газообразных продуктов, выпадением или растворением осадков. Установление подлинности неорганических лекарственных веществ заключается в обнаружении с помощью химических реакций катионов и анионов, входящих в состав молекул. Химические реакции, применяемые для идентификации органических лекарственных веществ, основаны на использовании функционального анализа.
Чистота лекарственных веществ устанавливается с помощью чувствительных и специфичных реакций, пригодных для определения допустимых пределов содержания примесей.
Количественные методы химического анализа подразделяют на гравиметрический и титриметрическии. Гравиметрический метод основан на взвешивании осажденного вещества в виде малорастворимого соединения или отгонки органических растворителей после извлечения лекарственного вещества. Метод точен, но длителен, так как предусматривает такие операции, как фильтрование, промывание, высушивание (или прокаливание) до постоянной масс,ы.
Наибольшее применение получил титриметрическии метод. Название происходит от слова "титр" (фр.) — концентрация. Основная операция метода—титрование, заключающаяся в постепенном приливании к раствору анализируемого вещества титрованного раствора до точки эквивалентности. По измеренному объему титрованного раствора рассчитывают количественное содержание вещества.
|
|
|
Титриметрическии метод анализа получил широкое распространение потому, что он позволяет использовать разнообразные химические реакции и определять вещества, учитывая их свойства и строение. Он выполняется быстро, с большой степенью точности, не нуждается в сложном оснащении и может использоваться как в лабораториях, так и в аптеках.
Для количественного определения лекарственного вещества титриметрическим методом необходимы титрованный (стандартный) раствор, набор простой лабораторной посуды (бюретки, пипетки, мерные колбы колбы для титрования) и средств фиксации точки эквивалентности (конечной точки титрования). Последнюю фиксируют как с помощью индикаторов, так и с помощью физико-химических методов, измеряя приборами физическую константу системы (потенциометрическое, амперометрическое титрование и др. способы). Однако не всякая химическая реакция может быть применима для процесса титрования. К реакциям, используемым в титриметрическом методе, предъявляются следующие требования:
1) возможность фиксировать точку эквивалентности (конечную точку титрования);
2) количественное протекание реакции, т. е. в реакцию должно вступить 100% анализируемого вещества. Для этого необходимо строго соблюдать определенные условия титрования:
3) реакция должна протекать быстро; не допускаются побочные реакции.
3.1.1Комплексометрический метод анализа
Основан на образовании комплексного соединения. Меркуриметрия используется для определения концентрации галогенидов, тиоцианатов, цианидов с помощью титрованного раствора — нитрата ртути (II). Предложен также раствор перхлората ртути (II). Титрованные растворы готовят с добавлением соответствующих кислот. Точку эквивалентности устанавливают потенциометрически или с помощью индикатора дифенилкарбазида, образующего с избытком соли ртути (II) сине-фиолетовое соединение:
|
|
|

При определении йодидов в процессе титрования образуется бесцветное комплексное соединение 4KI + Hg(NO3)2= K2[HgI4] + 2KNO3.
Точку эквивалентности определяют по образованию неисчезающего красного осадка дийодида ртути (II) K2[HgI4] + Hg(NO3)2 = 2HgI2 + 2KNO3.
Йодиды можно титровать с индикатором дифенилкарбазидом, если в титруемый раствор добавить несколько миллилитров этанола. Красный осадок дийодида ртути (II) растворяется в этаноле, и тогда точку эквивалентности определяют с индикатором по появлению сине-фиолетового окрашивания. Титрование выполняется в кислой среде.
При работе с солями ртути (II) необходимо соблюдать осторожность, помнить, что растворимые соли ртути ядовиты.
К комплексиметрическому титрованию относится куприметрическое определение левомицетина. К раствору левомицетина добавляют несколько капель раствора гидроксида натрия, мурексид (как индикатор) и медленно приливают титрованный раствор сульфата меди до изменения окраски раствора из фиолетовой в коричнево-красную, сравнивая ее с окраской контрольного раствора.
При добавлении гидроксида натрия к раствору левомицетина происходит взаимодействие
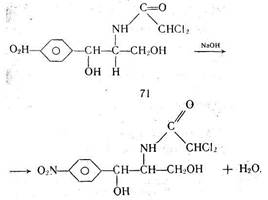
В процессе титрования образуется комплексное соединение
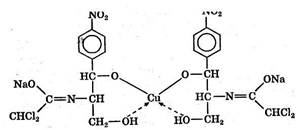
Комплексонометрический метод основан на реакции образования прочных комплексов полиаминокарбоновых кислот с ионами металлов (Са2+, Mg2+, Zn2+, Bi3+ и др.). Наиболее широко применяется динатриевая соль этилендиаминтетрауксусной кислоты (трилон Б). Трилон Б наряду с карбоксильными группами содержит аминный азот. Вследствие такого строения он является кислотой и комплексообразующим веществом. Многие металлы заменяют атомы водорода карбоксильных групп, одновременно связываясь координационно с азотом аминогруппы и образуя прочные комплексы трило-на Б с металлом.
Двухзарядный катион (например, Са2+) образует комплексное соединение следующего состава:
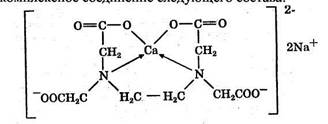
Образование комплексов можно представить схематично:
Na2H2I —> 2Na+ + H2I2
Ме2+ + H2I2 = Mel2- + 2H+
где Na2H2I— трилон Б; Me — ион металла. Как видно из приведенной схемы, реакция образования комплексов сопровождается накоплением протонов в растворе, поэтому связывание Н"1"-ионов должно способствовать образованию комплекса. Наиболее благоприятный для комплексообразования реакцией среды является рН 8—10. Поэтому титрование солей металлов трилоном Б проводят в присутствии аммиачного буфера. Для установления точки эквивалентности применяются специальные индикаторы, которые являются органическими красителями. К ним относятся кислотный хром темно-синий, кислотный хром черный специальный, называемый эриохром черный Т, мурексид, калькон-карбоновая кислота и др. Процесс комплексонометрического титрования заключается в том, что к исследуемому раствору, содержащему определяемый катион, при строго определенном значении рН прибавляют индикатор, при этом образуется хорошо растворимое в воде окрашенное комплексное соединение индикатора с ионом определяемого металла. При титровании трилоном Б этот комплекс разрушается и образуется более прочный, как правило бесцветный, комплекс иона металла с трилоном Б. При этом выделяется анион индикатора, который окрашивает раствор в цвет, присущий свободному индикатору при данном значении рН:
|
|
|
Ca2 + H2Ind = CaInd- + 2H+
Calnd + H2I2- = Cal2- + H2Ind
Комплексонометрическое титрование осуществляется как методом прямого, так и методом обратного титрования. Оно позволяет определять количественное содержание солей, оксидов металлов магния, кальция, цинка, свинца, висмута, ртути и др. Метод пригоден также для раздельного определения солей металлов в смеси. Раздельное определение солей кальция и магния при их совместном присутствии основано на том, что растворимость соединений титруемых солей зависит от величины рН в анализируемом растворе. Аликвотную часть раствора титруют вначале с индикатором эриохром черным при рН = 9 в присутствии аммиачного буферного раствора, причем титруются обе соли. В другой аликвотной части определяют соль кальция. В раствор добавляют несколько миллилитров 20 %-ного раствора гидроксида натрия, рН этого раствора изменяется от 9 до 12. В этих условиях соли магния осаждаются в виде гидроксида магния, и далее титруют соль кальция с индикатором мурексидом.
|
|
|
Интерес представляет косвенное комплексонометрическое определение аминопроизводных и солей органических оснований (гидрохлорида папаверина, прозерина, спазмолитина, производных фенотиазина). В этом случае используется раствор тетрароданоцинкат (П)-аммония (ТРЦ), который получают при взаимодействии тиоцианата аммония и сульфата цинка:
4NH SCN + ZnSO4 = (NH4)[Zn(SCN)4 ] + NH4SO4.
Для приготовления 0,5 М раствора ТРЦ берут 144 г сульфата цинка, помещают в мерную колбу вместимостью 1 л, добавляют 152 г. тиоцианата аммония, растворяют в воде и доводят водой до 1 л. Тщательно перемешивают, фильтруют через вату, хранят при комнатной температуре. При хранении реактива может выпасть осадок или измениться цвет. Несмотря на эти изменения, реактив годен к применению.
При добавлении реактива ТРЦ к анализируемому раствору образуется осадок комплексной соли. Например, при определении прозерина происходит осаждение его в соответствии с уравнением реакции
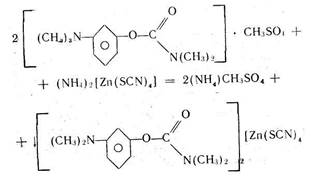
Осадок экстрагируют точно измеренным объемом хлороформа при энергичном взбалтывании в течение 2 мин н фильтруют через бумажный фильтр в сухую колбу. В колбу для титрования отбирают пипеткой определенный объем фильтрата, приливают избыток титрованного раствора трилона Б. Часть титранта вступает во взаимодействие с цинком, образуя прочное комплексное соединение. Не вошедший в реакцию титрант в присутствии аммиачного буферного раствора и индикатора хром темно-синего оттитровывают раствором сульфата цинка.
3.1.2 Метод сжигания в колбе с кислородом
Метод сжигания в колбе с кислородом для определения галогенов и серы в органических соединениях состоит из методики сжигания с последующим соответствующим титриметрическим определением. Сжигание органического материала в кислороде дает водорастворимые неорганические продукты, которые определяются, если предписано, для каждого отдельного элемента.
Сжигание проводят в подходяшей конической колбе, в пробку которой вплавлен конец платиновой проволоки. Если в статье нет других указаний, используют колбу емкостью 500 мл. К другому концу проволоки прикреплен кусочек платиновой сетки для укрепления образца, который во время сгорания не должен соприкасаться с поглощающей жидкостью.
3.1.3 Метод кислотно – основного титрования
Осуществляется в воде и в неводных средах. Данный метод используется в 40 процентах методик, применяющихся для анализа лекарственных веществ. Им определяют концентрацию кислот, оснований, солей. В основе титрования лежи реакция взаимодействия протонов с гидроксид-ионами: НзО+ + ОН" = 2Н2О. Титрованными (стандартными растворами являются растворы сильных кислот и сильных оснований. В процессе титрования изменяется рН системы. В зависимости от свойств определяемого вещества точка эквивалентности при титровании в воде может соответствовать различным величинам рН: Очевидно важно подобрать индикатор таким образом, чтобы величина рН в точке эквивалентности находилась в интервале перехода окраски выбранного индикатора.
|
|
|
В качестве индикаторов служат красители, изменяющие окраску в широком интервале рН от 1,2 до 10,5. Наиболее часто используются индикаторы: метиловый оранжевый (3,1—4,4); метиловый красный (4,8—6,0); фенолфталеин (8,2—10,0); тимол-фталеин (9,4—10,6).
Значительное количество лекарственных веществ проявляет способность отщеплять или присоединять протоны и согласно современным теориям являться кислотами или основаниями. Мерой кислотности вещества служит величина показателя кислотности рКа = -lgKa, где Ка— константа ионизации. Чем меньше величина рКа, тем сильнее кислота, тем легче отщепляются протоны. Аналогично рКв — показатель основ-ности вещества. Чем меньше величина рКв, тем сильнее основание, тем активнее вещество присоединяет протоны. Значения рКа и рКв для одного и того же вещества в разных растворителях различны, и этот фактор используют для выбора условий титрования.
ГФ XI приводит значения рКа для ряда лекарственных веществ в различных растворителях. Зная величину рКа, можно решить вопрос о возможности и условиях титрования вещества. Например, для соляной кислоты в воде рКа = 0,8; для уксусной кислоты рКа= 4,75; для ацетилсалициловой кислоты рКа = 3,50. Эти кислоты можно титровать в воде раствором гидроксида натрия. Если величина рКа больше восьми единиц рН, то водная среда не подходит. Например, для титрования барбитала (рКа==7,47), фенола (рКа=9,89), борной кислоты (рКа = 9,24) требуются особые условия. Барбитал титруют в среде диметилформамида бензольно-метанольным раствором гидроксида натрия. Борную кислоту превращают добавлением глицерина в диглицеринборную кислоту, которая является более сильной кислотой.
Свои основные свойства в водных и спиртовых средах проявляют лекарственные вещества, присоединяющие протон. Это—амидопирин (рКв = 9,2), гексаметилентетрамин (рКв=9,1), алкалоиды, например кодеин (рКв =6,0),. поэтому их можно титровать раствором сильной кислоты.
В водной среде кислотами титруют натриевые соли слабых кислот, так как в их растворе вследствие гидролиза образуется щелочная среда. Соли алкалоидов, в.водных растворах которых возникает кислая среда вследствие гидролиза, титруют раствором гидроксида натрия. В процессе титрования солей образуются кислоты или основания, присутствие их оказывает существенное влияние на рН раствора, поэтому их удаляют путем экстрагирования растворителями, не смешивающимися с водой. Например, салицилат натрия, бензоат натрия титруют в присутствии эфира. А соли алкалоидов в присутствии спиртово-хлороформной смеси (1:1). Для алкалиметрического определения аминокислот используется метод формольного титрования (титрование по Серенсену).
Наличие аминогруппы, способной присоединять протоны, и карбоксильной группы, отдающей протоны, приводит к тому, что в водных растворах аминокислоты существуют в виде диполярных ионов +NH3RCOO, поэтому полностью оттитровать такие вещества раствором гидроксида натрия не удается. Во избежание этого в раствор перед титрованием добавляют нейтрализованный формалин. Образуется N-метиленовое производное и устраняется влияние аминогруппы:
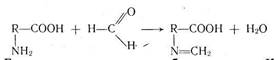
Если вещество — очень слабая кислота с рКа > 9, например теофиллин (рКа = 11,40), его непосредственно оттитровать нельзя. В таком случае прибегают к заместительному титрованию, сущность которого заключается в том, что к раствору анализируемого вещества добавляют несколько капель раствора нитрата серебра. Выделяющееся эквивалентное количество азотной кислоты определяют, алкалиметрически:
Титрование в неводных средах имеет преимущество перед водным титрованием потому, что позволяет определять концентрацию слабых кислот и оснований, часто мало растворимых в воде. Этот метод позволяет также определять соли слабых кислот и слабых оснований, которые невозможно оттитровать в воде. Удобен метод и для анализа многокомпонентных смесей, часто без их предварительного разделения. Метод позволяет определять физиологически активную часть в солях алкалоидов.
Метод неводного титрования дает более точные результаты по сравнению с титрованием в воде, так как вследствие небольшого поверхностного натяжения неводных растворителей размеры капель титрованных растворов меньше капель водных растворов.
3.1.4 Не водное титрование
Кислоты и основания в течение длительного времени определялись как вещества, которые при растворении в воде образуют соответственно ион водорода и гидроксилъный ион. Это определение, введенное Аррениусом, не учитывает того факта, что, свойства, характерные для кислот и оснований, могут проявляться также в других растворителях. Более общее определение принадлежит Брёнстеду, который рассматривает кислоту как вещество, выделяющее протоны (донор протонов), а основание как вещество, присоединяющее протоны (акцептор протонов). Еще более широкое определение дано Льюисом, считающим кислотой любое вещество, которое принимает пару электронов, а основанием — любое вещество, которое отдает пару электронов; нейтрализацию же он определяет как образование координационной связи между кислотой и основанием.
Кажущаяся сила кислоты или основания определяется степенью их реакции с растворителем. В водных растворах все сильные кислоты являются одинаково сильными, потому что они реагируют с растворителем, подвергаясь почти полному превращению в ион гидроксония (Н3О+) и кислотный анион. В слабо протофильном растворителе, например в уксусной кислоте, степень образования иона ацетония (CH3COOH2) вследствие присоединения протона обеспечивает более чувствительную дифференциацию силы кислот и показывает следующий порядок уменьшения их силы: хлорная, бромистоводородная, серная, соляная и азотная.
Уксусная кислота реагирует с водой не полностью, образуя ион гидроксония и, следовательно, является слабой кислотой. В основании, например в этилендиамине, она, напротив, реагирует с растворителем так полно, что ведет себя как сильная кислота.
Этот так называемый эффект выравнивания силы кислот наблюдается также для оснований. В серной кислоте все основания имеют также одну и ту же силу. По мере уменьшения кислотных свойств растворителя в ряду серная кислота — уксусная кислота — фенол — вода — пиридин — бутиламин, растворенные в них основания становятся "постепенно слабее и разница между ними становится более четко выряженной. В порядке уменьшения силы сильными основаниями для неводного титрования являются метилат калия, метилат натрия, метилат лития и гидроокись тетрабутиламмония.
Многие нерастроримые в поде соединения проявляют кислотные или основные свойства при растворении в органических растворителях, Таким образом, выбор подходящего растворителя позволяет определять многие такие соединения с помощью неродного титрования. Далее, в зависимости от того, какая часть соединения является физиологически активной, можно титровать эту часть путем травильного выбора растворителя и титранта. Чистые вещества можно титровать непосредственно, но часто бывает необходимо отделить активный ингредиент лекарственных форм от мешающих наполнителей и носителей.
К соединениям, которые можно титровать как кислоты относятся кислотные галогениды, ангидриды кислот, карбоновые кислоты, аминокислоты, энолы, такие, как барбитураты и ксантины, имиды, фенолы, пирролы, сульфаниламиды. К соединениям, которые можно титровать как основания, относятся амины, азотсодержащие гетероциклические соединения, четвертичные аммониевые соединения, щелочные соли органических кислот, щелочные соли неорганических кислот и некоторые соли аминов. Многие соли галоидоводородных кислот можно титровать в уксусной кислоте или уксусном ангидриде после прибавления ацетата ртути, который удаляет ион галоида переведенном в неионизированный комплекс галогенида ртути. Гидрохлориды слабых оснований, не содержащие группировок, способных ацетилироваться, можно также титровать в уксусном ангидриде без добавления ацетата ртути, используя в качестве индикатора малахитовый зеленый или кристаллический фиолетовый. Титрования, проводимые при избытке уксусного ангидрида, следует применять с осторожностью, так как любая реакция ангидрида с титруемым веществом может принести к заниженным результатам.
При титровании основных соединений обычно используют объемный раствор хлорной кислоты в ледяной уксусной кислоте, хотя в особых случаях удобнее использовать раствор хлорной кислоты в диоксане. При титровании кислых соединений часто применяют объемный раствор метилата лития в растворе метанол — толуол. Для многих случаев удобно использовать раствор гидроокиси тетрабутиламмония в толуоле; метилат натрия, ранее широко применявшийся, часто может давать вызывающий затруднения желатинообразиый осадок.
Чтобы исключить влияние углекислого газа, растворители для кислотных соединений в процессе титрования должны быть защищены от избыточного действия воздуха подходящей пробкой или инертным газом. Следует провести контрольный опыт; обычно объем 0,1 моль/л титранта не должен превышать 0,01 мл на 1 мл растворителя.
Конец титрования можно определять визуально по изменению окраски или потенциометрически. Если применяется каломельный электрод сравнения, то удобнее заменить водный раствор хлорида калия и соленом мостике на раствор перхлората лития в уксусной кислоте ИР для титрования в кислых растворителях и на раствор хлорида калия в метаноле для титрования в основных растворителях. Следует помнить, что некоторые обычно используемые индикаторы (например, кристаллический фиолетовый) подвергаются постепенному изменению окраски, поэтому при оценке пригодности метода неводного титрования для конкретного случая необходимо проследить за тем, чтобы при потенциометрическом титровании вещества изменение окраски в конечной точке титрования соответствовало максимальной величине dE/dV (где Е — электродвижущая сила, а V — объем титранта).
Если используют титранты, приготовленные с растворителями, имеющими относительно высокий коэффициент расширения (например, с ледяной уксусной кислотой, толуолом и т. п.), следует проследить за тем, чтобы были компенсированы различия в температуре между временем "применения и временем стандартизации титранта.
3.1.5 Нитритометрия
Нитритометрия — титриметрический метод, применяемый главным образом для количественного определения первичных ароматических амнион.
Прибор, обычно используемый в методике электрометрического титрования нитритом, состоит из открытого сосуда для титрования, содержащего два платиновых электрода, соединенных подходящей цепью. Электроды должны иметь разность потенциалов порядка 50—100 мВ. Электрическая цепь должна включать прибор для измерения силы тока с чувствительностью от 0,1 до 1 нА, обычно со стрелкой индикатором. Сосуд для титрования должен быть снабжен соответствующим механическим или магнитным перемешивающим устройством; для перемешивания раствора также может быть использован поток азота, проходящий через раствор. Электроды должны быть изготовлены из платиновой проволоки диаметром 0,5 мм и длиной около 20 мм. Перед каждым применением электроды следует очищать погружением на несколько секунд в кипящую азотную кислоту (1000 г/л) ИР, к которой предварительно прибавлен хлорид железа (III) P в количестве 1мг/мл. Затем электроды тщательно промывают водой.
|
|
|


