 |
Тема «Железо и его соединения» в школьных программах по химии
|
|
|
|
ВВЕДЕНИЕ
Железо играло и играет исключительную роль в материальной истории человечества. Первое металлическое железо, попавшее в руки человека, имело, вероятно, метеоритное происхождение. Руды железа широко распространены и часто встречаются даже на поверхности Земли, но самородное железо на поверхности крайне редко. Вероятно, еще несколько тысяч лет назад человек заметил, что после горения костра в некоторых случаях наблюдается образование железа из тех кусков руды, которые случайно оказались в костре. При горении костра восстановление железа из руды происходит за счет реакции руды как непосредственно с углем, так и с образующимся при горении оксидом углерода (II) СО. Возможность получения железа из руд существенно облегчило обнаружение того факта, что при нагревании руды с углем возникает металл, который далее можно дополнительно очистить при ковке. Получение железа из руды с помощью сыродутного процесса было изобретено в Западной Азии во 2-м тысячелетии до нашей эры. Период с 9 – 7 века до нашей эры, когда у многих племен Европы и Азии развилась металлургия железа, получил название железного века, пришедшего на смену бронзовому веку. Усовершенствование способов дутия (естественную тягу сменили меха) и увеличение высоты горна (появились низкошахтные печи — домницы) привело к получению чугуна, который стали широко выплавлять в Западной Европе с 14 века. Полученный чугун переделывали в сталь. С середины 18 века в доменном процессе вместо древесного угля начали использовать каменно-угольный кокс. В дальнейшем способы получения железа из руд были значительно усовершенствованы, и в настоящее время для этого используют специальные устройства — домны, кислородные конвертеры, электродуговые печи.
|
|
|
Целью моей работы является освещение основных наиболее остро стоящих экологических проблем, связанных с железом и его соединениями, и возможные пути их решения.
Задачи:
1. Обзор состояния данного вопроса в современной российской школе.
2. Анализ школьных программ и учебников, а также другой литературы, показывающих как тема: «Железо и его соединения»изучаются в средней школе.
3. Составить план урока, на котором была бы успешно проведена экологизация знаний.
ГЛАВА 1. ИЗУЧЕНИЕ ТЕМЫ: «ЖЕЛЕЗО И ЕГО СОЕДИНЕНИЙ» В ШКОЛЬНОМ КУРСЕ ХИМИИ
Историческая справка
В земной коре железо распространено достаточно широко — на его долю приходится около 4,1% массы земной коры (4-е место среди всех элементов, 2-е среди металлов). Известно большое число руд и минералов, содержащих железо. Наибольшее практическое значение имеют красные железняки (руда гематит, Fe2O3; содержит до 70% Fe), магнитные железняки (руда магнетит, Fe3О4; содержит 72,4% Fe), бурые железняки (руда гидрогетит НFeO2·nH2O), а также шпатовые железняки (руда сидерит, карбонат железа, FeСО3; содержит около 48% Fe). В природе встречаются также большие месторождения пирита FeS2 (другие названия — серный колчедан, железный колчедан, дисульфид железа и другие), но руды с высоким содержанием серы пока практического значения не имеют. По запасам железных руд Россия занимает первое место в мире. В морской воде 1·10–5 — 1·10–8% железа.
Тема «Железо и его соединения» в школьных программах по химии
В программе школьного курса химии на изучении темы «Железо и его соединения» отводится 5 часов; эта тема разбита на следующие подразделы: Общие понятия о положении железа в периодической системе химических элементов и строение атома. Основные методы получения железа-восстановление из оксидов железа и электролиз водных растворов солей железа. Физические, химические свойства и применение. Основные соединения железа и их получение. Экологические аспекты данной темы в школьной литературе изложены очень поверхностно или не изложены вовсе.
|
|
|
В школьных учебниках «Химия.9 класс»/Г. Е. Рудзитис, Ф. Г. Фельдман, «Химия. 9класс»/Н. С. Ахметов, и Пособие по химии для поступающих в вузы/ Г. П. Хомченко, на эту тему выделено три основных параграфа: § 1.Положение железа в периодической системе химических элементов и строение атома § 2.Нахождение железа в природе,его получение, свойства и применение § 3.Соединения железа, и мы будем рассматривать каждый параграф более подробно.
§ 1. Положение железа в периодической системе химических элементов и строение атома
Fe
d- элемент VIII группы; порядковый номер – 26; атомная масса – 56; (26p11; 30 n01), 26ē[1]

| 1s22s22p63s23p63d64s2 |
Металл средней активности, восстановитель.
Основные степени окисления - +2, +3

§ 2. Нахождение железа в природе,его получение и свойства
Нахождение в природе.
Железо является вторым по распространенности металлом в природе (после алюминия). В свободном состоянии железо встречается только в метеоритах, падающих на землю [2]. Наиболее важные природные соединения:
Fe2O3 • 3H2O - бурый железняк;
Fe2O3 - красный железняк;
Fe3O4(FeO • Fe2O3) - магнитный железняк;
FeS2 - железный колчедан (пирит).
Соединения железа входят в состав живых организмов.
Получение железа.
В промышленности железо получают восстановлением его из железных руд углеродом (коксом) и оксидом углерода (II) в доменных печах [1, 3]. Химизм доменного процесса следующий:
C + O2 = CO2,
CO2 + C = 2CO.
3Fe2O3 + CO = 2Fe3O4 + CO2,
Fe3O4 + CO = 3FeO + CO2,
FeO + CO = Fe + CO2.
Его также можно получить:
1)восстановлением железа из его оксида, например,  водородом при нагревании;
водородом при нагревании;
2)восстановлением железа из его оксидов  и
и 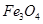 алюминотермическим методом;
алюминотермическим методом;
3)электролизом водных растворов солей железа (II) [1].
Физические свойства.
Железо – серебристо серый металл, обладает большой ковкостью, пластичностью и сильными магнитными свойствами. Плотность железа – 7,87 г/см3, температура плавления 1539°С [1].
У Хомченко [3] также написано, что железо легко намагничивается и размагничивается, а потому применяется в качестве сердечников динамомашин и электромоторов. Кроме того, железо состоит из четырех стабильных изотопов с массовыми числами 54, 56(основной), 57 и 58. Применяются радиоактивные изотопы  и
и  .
.
|
|
|
Химические свойства
В реакциях железо является восстановителем. Однако при обычной температуре оно не взаимодействует даже с самыми активными окислителями (галогенами, кислородом, серой), но при нагревании становится активным и реагирует с ними:
2Fe + 3Cl2 = 2FeCl3 Хлорид железа (III)
3Fe + 2O2 = Fe3O4(FeO · Fe2O3) Оксид железа (II,III)
Fe + S = FeS Сульфид железа (II)
При очень высокой температуре железо реагирует с углеродом, кремнием и фосфором:
3Fe + C = Fe3C Карбид железа (цементит)
3Fe + Si = Fe3Si Силицид железа
3Fe + 2P = Fe3P2 Фосфид железа (II)
Железо реагирует со сложными веществами.
Во влажном воздухе железо быстро окисляется (корродирует):
4Fe + 3O2 + 6H2O = 4Fe(OH)3,
O
Fe(OH)3 = Fe
O – H + H2O
Ржавчина
Железо находится в середине электрохимического ряда напряжений металлов, поэтому является металлом средней активности. Восстановительная способность у железа меньше, чем у щелочных, щелочноземельных металлов и у алюминия. Только при высокой температуре раскаленное железо реагирует с водой(700-900):
3Fe + 4H2O = Fe3O4 + 4H2
Железо реагирует с разбавленными серной и соляной кислотами, вытесняя из кислот водород:
Fe + 2HCl = FeCl2 + H2
Fe + H2SO4 = FeSO4 + H2
При обычной температуре железо не взаимодействует с концентрированной серной кислотой, так как пассивируется ею [3]. При нагревании концентрированная H2SO4 окисляет железо до сульфита железа (III):
2Fe + 6H2SO4 = Fe2(SO4)3 + 3SO2 + 6H2O.
Разбавленная азотная кислота окисляет железо до нитрата железа (III):
Fe + 4HNO3 = Fe(NO3)3 + NO + 2H2O.
Концентрированная азотная кислота пассивирует железо.
Из растворов солей железо вытесняет металлы, которые расположены правее его в электрохимическом ряду напряжений:
Fe + CuSO4 = FeSO4 + Cu, Fe0 + Cu2+ = Fe2+ + Cu0.
Применение и биологическая роль железа и его соединений.
Важнейшие сплавы железа – чугуны и стали – являются основными конструкционными материалами практически во всех отраслях современного производства [1].
|
|
|
Хлорид железа (III) FeCl3 применяется для очистки воды. В органическом синтезе FeCl3 применяется как катализатор. Нитрат железа Fe(NO3)3 · 9H2O используют при окраске тканей.
Железо является одним из важнейших микроэлементов в организме человека и животных (в организме взрослого человека содержится в виде соединений около 4 г Fe). Оно входит в состав гемоглобина, миоглобина, различных ферментов и других сложных железобелковых комплексов, которые находятся в печени и селезенке. Железо стимулирует функцию кроветворных органов [2, 3].
§ 3.Соединения железа
Соединения железа (II)
Оксид железа (II) FeO – черное кристаллическое вещество, нерастворимое в воде. Оксид железа (II) получают восстановлением оксида железа(II,III) оксидом углерода (II):
Fe3O4 + CO = 3FeO + CO2.
Оксид железа (II) – основной оксид, легко реагирует с кислотами, при этом образуются соли железа(II):
FeO + 2HCl = FeCl2 + H2O, FeO + 2H+ = Fe2+ + H2O.
Гидроксид железа (II) Fe(OH)2 – порошок белого цвета, не растворяется в воде. Получают его из солей железа (II) при взаимодействии их со щелочами:
FeSO4 + 2NaOH = Fe(OH)2¯ + Na2SO4,
Fe2+ + 2OH- = Fe(OH)2¯.
Гидроксид железа () Fe(OH)2 проявляет свойства основания, легко реагирует с кислотами:
Fe(OH)2 + 2HCl = FeCl2 + 2H2O,
Fe(OH)2 + 2H+ = Fe2+ + 2H2O.
При нагревании гидроксид железа (II) разлагается:
Fe(OH)2 = FeO + H2O.
Соединения со степенью окисления железа +2 проявляют восстановительные свойства, так как Fe2+ легко окисляются до Fe+3:
Fe+2 – 1e = Fe+3
Так, свежеполученный зеленоватый осадок Fe(OH)2 на воздухе очень быстро изменяет окраску – буреет. Изменение окраски объясняется окислением Fe(OH)2 в Fe(OH)3 кислородом воздуха:
4Fe+2(OH)2 + O2 + 2H2O = 4Fe+3(OH)3.
Восстановительные свойства проявляют и соли двухвалентного железа, особенно при действии окислителей в кислотной среде. Например, сульфат железа (II) восстанавливает перманганат калия в сернокислотной среде до сульфата марганца (II):
10Fe+2SO4 + 2KMn+7O4 + 8H2SO4 = 5Fe+32(SO4)3 + 2Mn+2SO4 + K2SO4 + 8H2O.
Качественная реакция на катион железа (II).
Реактивом для определения катиона железа Fe2+ является гексациано (III) феррат калия (красная кровяная соль) K3[Fe(CN)6]:
3FeSO4 + 2K3[Fe(CN)6] = Fe3[Fe(CN)6]2¯ + 3K2SO4.
При взаимодействии ионов [Fe(CN)6]3- с катионами железа Fe2+ образуется темно-синий осадок – турнбулева синь:
3Fe2+ +2[Fe(CN)6]3- = Fe3[Fe(CN)6]2¯ [3].
Соединения железа (III)
Оксид железа (III) Fe2O3 – порошок бурого цвета, не растворяется в воде. Оксид железа (III) получают:
А) разложением гидроксида железа (III):
2Fe(OH)3 = Fe2O3 + 3H2O
Б) окислением пирита (FeS2):
|
|
|
4Fe+2S2-1 + 11O20 = 2Fe2+3O3 + 8S+4O2-2.
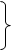

 Fe+2 – 1e ® Fe+3
Fe+2 – 1e ® Fe+3
2S-1 – 10e ® 2S+4
 O20 + 4e ® 2O-2 11e
O20 + 4e ® 2O-2 11e
Оксид железа (III) проявляет амфотерные свойства:
А) взаимодействует с твердыми щелочами NaOH и KOH и с карбонатами натрия и калия при высокой температуре:
Fe2O3 + 2NaOH = 2NaFeO2 + H2O,
Fe2O3 + 2OH- = 2FeO2- + H2O,
Fe2O3 + Na2CO3 = 2NaFeO2 + CO2.
Феррит натрия
Гидроксид железа (III) получают из солей железа (III) при взаимодействии их со щелочами:
FeCl3 + 3NaOH = Fe(OH)3¯ + 3NaCl,
Fe3+ + 3OH- = Fe(OH)3¯.
Гидроксид железа (III) является более слабым основанием, чем Fe(OH)2, и проявляет амфотерные свойства (с преобладанием основных). При взаимодействии с разбавленными кислотами Fe(OH)3 легко образует соответствующие соли:
Fe(OH)3 + 3HCl «FeCl3 + H2O
2Fe(OH)3 + 3H2SO4 «Fe2(SO4)3 + 6H2O
Fe(OH)3 + 3H+ «Fe3+ + 3H2O
Реакции с концентрированными растворами щелочей протекают лишь при длительном нагревании. При этом получаются устойчивые гидрокомплексы с координационным числом 4 или 6:
Fe(OH)3 + NaOH = Na[Fe(OH)4],
Fe(OH)3 + OH- = [Fe(OH)4]-,
Fe(OH)3 + 3NaOH = Na3[Fe(OH)6],
Fe(OH)3 + 3OH- = [Fe(OH)6]3-.
Соединения со степенью окисления железа +3 проявляют окислительные свойства, так как под действием восстановителей Fe+3 превращается в Fe+2:
Fe+3 + 1e = Fe+2.
Так, например, хлорид железа (III) окисляет йодид калия до свободного йода:
2Fe+3Cl3 + 2KI = 2Fe+2Cl2 + 2KCl + I20
Качественные реакции на катион железа (III)
А) Реактивом для обнаружения катиона Fe3+ является гексациано (II) феррат калия (желтая кровяная соль) K2[Fe(CN)6].
При взаимодействии ионов [Fe(CN)6]4- с ионами Fe3+ образуется темно-синий осадок – берлинская лазурь:
4FeCl3 + 3K4[Fe(CN)6] «Fe4[Fe(CN)6]3¯ +12KCl,
4Fe3+ + 3[Fe(CN)6]4- = Fe4[Fe(CN)6]3¯.
Б) Катионы Fe3+ легко обнаруживаются с помощью роданида аммония (NH4CNS). В результате взаимодействия ионов CNS-1 с катионами железа (III) Fe3+ образуется малодиссоциирующий роданид железа (III) кроваво-красного цвета:
FeCl3 + 3NH4CNS «Fe(CNS)3 + 3NH4Cl,
Fe3+ + 3CNS1- «Fe(CNS)3 [1,3]
|
|
|


