 |
Характеристика готового продукта
|
|
|
|
Ортофосфорная кислота (Н3РО4) – бесцветные кристаллы, плотность 1,87, температура плавления 42,35°С, теплота образования DН0298= -309,4 ккал/моль.
Безводная Н3РО4 склонна к переохлаждению. При нормальной температуре инертна и ниже 350°С не восстанавливается углеродом и водородом. При повышенных температурax реагирует с большинством металлов и их окислов, действуя даже на кварц, золото и т.д. С водой Н3РО4 смешивается во всех отношениях. Кипение растворов Н3РО4 сопровождается разложением и образованием азеотропной смеси, содержащей 91,1-92,1%Р2О5 (чистая Н3РО4 содержит 72,4% Р2О5). Для Н3РО4 окислительные и восстановительные свойства не характерны. При обычной температуре в водных растворах Н3РО4 взаимодействует лишь с щелочами. При повышенных температурax и пониженных давлениях Н3РО4 реагирует со спиртами с образованием эфиров. Однако чаще всего эфиры Н3РО4 получают взаимодействием спиртов ROH с РОС13 или РС15.
Фосфорная кислота - важный полупродукт для производства удобрений, технических. реактивов, например, фосфатов аммония, натрия, кальция и т.д. Н3РО4 применяют в синтезе ряда органических продуктов, в производстве активированного угля, для создания на металлах защитных покрытий. Очищенная, или так называемая пищевая Н3РО4, применяется в производстве безалкогольных напитков, фармацевтических препаратов, для приготовления кормовых концентратов и т.д.
Модели ХТС
Химическая модель
Разложение фосфата при избытке ионов кальция в растворе происходит с образованием фосфополугидрата и монокальцийфосфата (МКФ):
Са5(РО4)3F + 5H2SO4 + 2,5H2O ® 3H3PO4 + 5CaSO4×0,5H2O + HF
Са5(РО4)3F + 7H3PO4 ® 5Ca(H2PO4)2 + HF
Далее, при снижении содержания ионов кальция в фосфорной пульпе, идет взаимодействие МКФ с черной кислотой с перекристаллизацией крупнокристаллических форм полугидрата сульфата кальция:
|
|
|
5Ca(H2PO4)2 + H2SO4 + 0,5H2O ® CaSO4×0,5H2O + 3H3PO4
Функциональная модель
      |
Структурная модель
      |
Операторная модель
 |
Технологическая схема
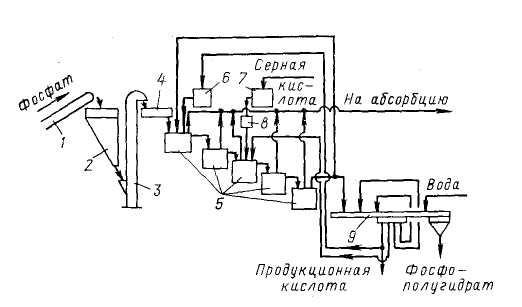
1 – ленточный конвейер; 2 – бункер; 3 – элеватор; 4 – весовой дозатор;
5 – экстракторы с мешалками; 6,7 – напорные баки; 8 – щелевой расходомер;
9 – карусельный вакуум-фильтр
В полугидратном процессе фосфатное сырье, фосфорная кислота и ретурная пульпа попадают в первый из двух каскадно расположенных реакторов 5 первой монокальцийфосфатной стадии процесса. В двух реакторах этой стадии при температуре 90-95°С в течение 1,2-1,7 ч фосфат разлагается 3,5-4,0 кратным (в расчете на образование Са(Н3РО4)2) избытком фосфорной кислоты. По истечении указанного времени на выходе из второго реактора коэффициент разложения фосфата достигает 98-99%.
В последующих трех реакторах 5 происходит экстракция фосфорной кислоты при взаимодействии вводимой в третий реактор серной кислоты и находящегося в пульпе монокальцийфосфата в присутствии второго фильтрата, поступающего с фильтра. Процесс идет очень быстро при температуре 95-100°С и при отсутствии в жидкой фазе свободной серной кислоты. Применение определенных способов подачи реагентов, способствующих минимизации возникающих в объеме реакционной пульпы градиентов температуры и концентраций, обеспечивает также минимальные значения величин пресыщения жидкой фазы по сульфату кальция. Такие меры позволяют выделять полугидрат в виде изометричных, близких к сферической форме кристаллов, сросшихся в агрегата диаметром до 100 мкм.
Пульпа, содержащая в жидкой фазе 45-50% Р2О5, делится на два потока: один (2/3 пульпы) возвращают в экстрактор, а второй (1/3 пульпы) направляют на разделение на карусельном вакуум-фильтре 9. Продукционную кислоту частично возвращают в процесс, осадок фосфополугидрата промывают водой противотоком.
|
|
|
Заключение
В данной курсовой работе рассмотрены методы получения экстракционной фосфорной кислоты. Наиболее перспективным является полугидратный способ получения фосфорной кислоты, так как дает возможность получения концентрированной фосфорной кислоты (35-37% Р2О5) и увеличение эффективности стадии фильтрации пульпы в 1,5-2 раза по сравнению с дигидратным способом.
В работе представлена характеристика исходного сырья и готовой продукции. Построены химическая, функциональная, структурная, операторная, технологическая модели ХТС по получению фосфорной кислоты.
Список использованной литературы
1. Кислотные методы переработки фосфатного сырья / Е.Л. Яхонтова, И.А. Петропавловский, В.Ф. Кармышов, И.А. Спиридонова. – М.: Химия, 1988. – 288 с.
2. Шуб Б.И. Перспективы развития полугидратного процесса получения экстракционной фосфорной кислоты / Б.И. Шуб, Э.В. Хлебодарова // Химическая промышленность. – 1999. - №11. – С.41-43.
3. Большая советская энциклопедия / под ред. А.Н. Прохорова. – М.: Советская энциклопедия, 1976. – Т.23.
4. Копылев В.Н. Технология экстракционной фосфорной кислоты / В.Н. Копылев. – М.: Химия, 1981. – 224 с.
|
|
|
12 |


