 |
Физико-химические закономерности получения полиамидов
|
|
|
|
При поликонденсации, называемой еще ступенчатой полимеризацией, макромолекулы образуются в результате молекулярных реакций функциональных групп мономеров без участия возбужденных частиц типа свободных радикалов или ионов. Промежуточный продукт – смесь олигомеров различной молекулярной массы – может быть выделен на любой стадии реакции. В настоящее время понятия ступенчатой полимеризации и поликонденсации не разделяют.
Согласно принципу Флори, реакционная способность функциональных групп в реакциях роста цепи ступенчатой полимеризации не зависит от молекулярной массы реагента.
Все реакции поликонденсации обратимы, однако, константа равновесия этой реакции может изменяться в широких пределах. Например, из наиболее практически важных реакций переэтерификации, полиэтерификации и поли-амидирования:
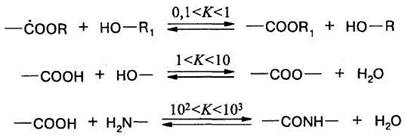
последняя имеет большую константу равновесия, главным образом, вследствие большей константы скорости прямой реакции. Это обстоятельство облегчает процесс получения полимера в производственных условиях.
Рассмотрим влияние константы равновесия на глубину протекания реакции. Последняя характеризуется степенью завершенности реакции X:
 (1)
(1)
где [М]0,[М] - исходная и текущая концентрации мономеров. Когда полимер получается из двух мономеров, принимается, что их концентрации равны, т. е. [М1]0 = [М2]0 = [М]0.
Константа равновесия приведенной выше реакции полиэтерификации описывается выражением:
 (2)
(2)
которое может быть представлено в виде:
 (3)
(3)
или
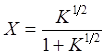 (4)
(4)
Далее рассмотрим связь константы равновесия со степенью полимеризации, т. е. количеством повторяющихся звеньев (остатков мономеров) в цепи, Очевидно, что в отсутствие реакции ограничения роста цепи  , откуда:
, откуда:
|
|
|
 (5)
(5)
Соотношение (5), связывающее среднечисловую степень полимеризации со степенью завершенности, называется уравнением Карозерса. Сочетание уравнений (4) и (5) приводит к зависимости, связывающей константу равновесия со степенью полимеризации:
 (6)
(6)
Уравнения (4) и (6) позволяют оценить предельно достижимые Х и 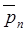 , т.е. выход и молекулярную массу при поликонденсации. Из табл. 6 следует, что продукт равновесной поликонденсации может быть назван полимером лишь при K» 104, хотя глубина протекания прямой реакции вполне приемлема при K» 103. Поэтому с практической точки зрения равновесная поликонденсация может считаться необратимой и использоваться для синтеза полимеров при K ³ 103 – 104.
, т.е. выход и молекулярную массу при поликонденсации. Из табл. 6 следует, что продукт равновесной поликонденсации может быть назван полимером лишь при K» 104, хотя глубина протекания прямой реакции вполне приемлема при K» 103. Поэтому с практической точки зрения равновесная поликонденсация может считаться необратимой и использоваться для синтеза полимеров при K ³ 103 – 104.
Таблица 6. Влияние константы равновесия К на степень завершенности реакции поликонденсации X и среднечисловую степень полимеризации 
| K, л/моль | X | 
|
| 1×10-4 | 0,001 | 1,01 |
| 1×10-2 | 0,096 | 1,1 |
| 1 | 0,50 | 2 |
| 10 | 0,76 | 4,16 |
| 1×102 | 0,91 | 11 |
| 1×103 | 0,97 | 32,6 |
| 1×104 | 0,99 | 101 |
Из приведенных выше данных по константам равновесия следует, что ни одна из наиболее часто используемых реакций поликонденсации не удовлетворяет этим требованиям, по крайней мере, с точки зрения необходимости достижения достаточной молекулярной массы полимера (большей, чем 104). Поэтому на практике низкомолекулярный продукт, реже полимер, удаляют из зоны реакции, т. е. поликонденсация протекает в неравновесном режиме. Очевидно, что низкомолекулярный продукт не может быть удален полностью, поэтому необходимо знать его предельно допустимую концентрацию, которая может быть рассчитана, исходя из константы равновесия. В этом случае уравнение (3) необходимо записать так, чтобы выразить в явном виде концентрацию низкомолекулярного продукта:
|
|
|
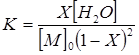 (7)
(7)
Далее, с привлечением уравнения Карозерса получаем:
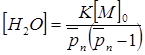 (8)
(8)
В таблице 7 приведены степени полимеризации продукта, получаемого при полиэтерификации в присутствии различных количеств воды.
Таблица 7. Влияние воды на степень полимеризации при поликонденсации с различными константами равновесия, [М]0 = 5 моль/л
| K, л/моль | 
| [Н2О], моль/л |
| 0,1 | 20 100 500 | 1,32×10-3 5,05×10-5 2,00×10-6 |
| 1 | 20 100 500 | 1,32×10-2 5,05×10-4 2,00×10-5 |
| 10 | 20 100 500 | 0,132 5,05×10-3 2,00×10-4 |
| 100 | 20 100 500 | 1,316 5,05×10-2 2,00×10-3 |
Из таблицы следует, что для получения достаточно высокомолекулярного полимера, даже при достаточно большой константе равновесия (порядка 102), допустимо содержание в реакционной смеси не более 1 % воды. Обычно вода и подобные ей низкомолекулярные продукты, например метанол, удаляются из реакционной среды отгонкой при атмосферном давлении, менее летучие продукты - отгонкой под вакуумом. Удалению летучих низкомолекулярных продуктов способствует высокая температура реакции, которая существенно превышает 200 °С при получении полиэфиров и полиамидов. [6]
Кинетика поликонденсации
Рассмотрим основные кинетические закономерности поликонденсации на примере амидирования. Катализаторами реакции является кислота. Механизм кислотного катализа к настоящему времени надежно установлен. Он включает две стадии:
1. Протонирование кислоты-реагента кислотой-катализатором (НА):
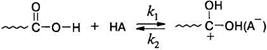
2. Атаки протонированным реагентом гидроксильной группы спирта с последующим распадом интермедиата до продуктов реакции:
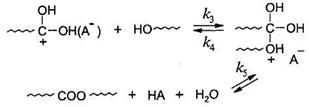
Если в данной реакции удалять воду, то можно учитывать лишь прямое направление реакции. Тогда:
 (9)
(9)
Неопределяемая величина [С+(ОН)2] может быть исключена с помощью выражения (10):
 (10)
(10)
В результате получаем:
 (11)
(11)
В отсутствие внешнего катализатора его функцию выполняет кислота-мономер. Тогда:
 , (12)
, (12)
где K' = k3K. Поскольку при поликонденсации концентрации разных функциональных групп обычно равны (в целях получения высокомолекулярного полимера), то уравнение (12) можно упростить:
 (13)
(13)
Интегрирование этого уравнения приводит к выражению:
|
|
|
 (14)
(14)
и далее, с использованием понятия степени завершенности реакции (1), приходим к конечному результату:
 (15)
(15)
Уравнение (15), исходящее из третьего порядка скорости по концентрации мономера, достаточно хорошо описывает экспериментальные данные. Встречающиеся отклонения при средних и глубоких степенях завершенности связаны с изменением состояния реакционной среды - уменьшением полярности, вследствие исчерпания карбоксильных и гидроксильных (или других полярных) групп мономеров, и возрастанием вязкости.
Степень ступенчатой полимеризации равна числу мономерных звеньев в цепи. При ступенчатой полимеризации двух гомофункциональных мономеров A-R-A и B-R -В степень полимеризации равна половине их количества в цепи. Сочетание (5) и (15) приводит к зависимости степени полимеризации от времени:
 (16)
(16)
Из этого уравнения следует, что темп нарастания молекулярной массы продукта поликонденсации уменьшается со временем. Данную зависимость не следует путать с той, что вытекает из уравнения Карозерса (5), согласно которому темп возрастания  с ростом конверсии увеличивается.
с ростом конверсии увеличивается.
Изложенное выше касалось самокатализируемой поликонденсации. При наличии специально введенного, так называемого внешнего катализатора, уравнение скорости отвечает второму порядку по концентрации мономера:
 (17)
(17)
Интегрирование (17) приводит к (18) и далее с использованием (5) к уравнению (19):
 (18)
(18)
 (19)
(19)
Из уравнения (19) следует, что при катализируемой поликонденсации имеет место линейная зависимость степени полимеризации от времени.
На практике самокатализируемая реакция используется при получении полиамидов.
При предыдущем изложении предполагалось равенство концентраций мономеров, что является одним из условий получения высокомолекулярного полимера при поликонденсации. Количественной мерой, отражающей степень эквивалентности концентраций мономеров, является параметр
 (20)
(20)
|
|
|
вследствие [М1] > [М2]. Связь среднечисловой степени полимеризации с параметром эквивалентности дается выражением:
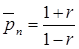 (21)
(21)
При строго эквивалентных количествах функциональных групп на концах макромолекул реакция между ними может продолжаться сколь угодно долго, теоретически – вплоть до образования гигантской макромолекулы. Из этого следует, что для стабилизации молекулярной массы полимера небольшой избыток одного из мономеров может оказаться полезным. В этом случае все макромолекулы будут иметь одинаковые функциональные группы, например А~~А, что исключает возможность реакции между ними. Для этих целей используют также малые добавки монофункционального соединения. При этом уравнение (21) по-прежнему применимо, однако параметр r рассчитывается по-другому. При поликонденсации двух гомофункциональных мономеров ARA и BR1B в присутствии монофункционального соединения R2B
 (22)
(22)
где [ARA] = [BR1B]. Коэффициент 2 вводится потому, что эффект добавки R2B аналогичен эффекту избытка бифункционального мономера BR1B, a уравнение (22) получено применительно к реакции двух бифункциональных мономеров. При поликонденсации гетерофункционального мономера ARB в присутствии BR1[6]
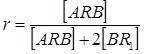 . (23)
. (23)
|
|
|


