 |
Кинетика кристаллизации чистых металлов.
|
|
|
|
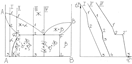
 Скорость кристаллизации определяется числом зарождающихся центров кристаллизации n и скоростью их роста m. В отсутствии переохлаждения m,n=0. По мере увеличения степени переохлаждения, происходит увеличение числа центров кристаллизации и скорости их роста, причем число n увеличивается быстрее m. Это связано с тем, что с увеличением степени переохлаждения уменьшается критический размер зародыша и их количество. Однако с увеличением степени переохлаждения уменьшается скорость диффузионных процессов, контролирующих рост зародыша. Практически процесс кристаллизации осуществляется по восходящим ветвям. Нисходящие ветви не реализуются, т.к. металл кристаллизуется при постоянной температуре.
Скорость кристаллизации определяется числом зарождающихся центров кристаллизации n и скоростью их роста m. В отсутствии переохлаждения m,n=0. По мере увеличения степени переохлаждения, происходит увеличение числа центров кристаллизации и скорости их роста, причем число n увеличивается быстрее m. Это связано с тем, что с увеличением степени переохлаждения уменьшается критический размер зародыша и их количество. Однако с увеличением степени переохлаждения уменьшается скорость диффузионных процессов, контролирующих рост зародыша. Практически процесс кристаллизации осуществляется по восходящим ветвям. Нисходящие ветви не реализуются, т.к. металл кристаллизуется при постоянной температуре.
Возможное существования металлов в различных кристаллизационных модификациях называется полиморфизмом или аллотропией. При определенных условиях, атомы, образующие кристаллическую решетку одного типа, перестраиваются с образованием кристаллической решетки другого типа. По сути это кристаллизационный процесс, т.к. перенастройка решетки из одного типа в другой происходит при постоянной температуре. Однако, т.к. этот процесс имеет место в твердом состоянии его называют перекристаллизацией. К полиморфным металлам относятся: железо, олово, титан, марганец, кобольт.
14,15,16. Основы теории сплавов.
Сплавом называют результат сплавления двух или более компонентов. Компоненты - это химически индивидуальные вещества образовывающие сплав.
Фаза – однородная часть системы отграниченная поверхностью раздела, при переходе через которую состав и свойства меняются скачкообразно.
В зависимости от характера компонентов, в сплаве могут образоваться хим. соединения, твердые растворы, механические смеси.
|
|
|
Хим. соединения.
Хим. соединения образуются при строго определенном количественном соотношении атомов. Для хим. соединения характерным является то, что кристаллическая решетка его отличается от кристаллической решетки сплавляемых компонентов. Если хим. соединение образуют металлы, то его называют интерметаллидом.
Твердые растворы.
Они образуются в том случае, когда в кристаллической решетке одного компонента атомы замещаются на атомы другого компонента. Это твердые растворы замещения. Бывают твердые растворы внедрения, твердые растворы вычитания.
 Твердые растворы замещения подразделяют на растворы неорганической и органической растворимости.
Твердые растворы замещения подразделяют на растворы неорганической и органической растворимости.
1) Основной металл, атомы в котором замещаются, называется растворителем.
2) Растворенный компонент.
Для того, чтобы получить твердый раствор неорганической растворимости замещаются атомы растворенного компонента. Необходимо выполнение трех условий:
а) Кристаллические решетки обоих компонентов являются изоморфными (однотипными)
б) Разница в атомных радиусах не должна превышать 14 или 15 %
в) Сплавляемие компоненты должны находиться в одной части периодической таблицы.
Невыполнение хотя бы одного из условий приводит к образованию твердых растворов ограниченной растворимости. К растворам, в которых атомы кристаллической решетки растворителя частично замещаются атомами растворимого компонента.
Твердые растворы внедрения.
Твердые растворы внедрения образуются, когда атомы одного компонента внедряются в пустоты или дефекты другого компонента. Такое возможно лишь в случае большого различия в атомных радиусах компонента. Твердые растворы внедрения образуют металлы с углеродом, азотом и твердые растворызамещения.
Твердые растворывычитания.
Они образуются на базе хим. соединений при недостатке атомом одного из компонентов. Отдельные узлы кристаллической решетки растворителя остаются вакантными.
|
|
|
Механические смеси.
Некоторые компоненты при сплавлении не взаимодействуют с образованием хим. соединений или твердых растворов. Они образуют механические смеси. Механические смеси отличаются от хим. соединений и твердых растворов тем, что в них сохраняются типы решеток характерных для сплавляемых компонентов.
Диаграммы состояния двойных сплавов.
 Диаграмма состояния представляет собой графическое отображение состояния сплава в зависимости от температуры, давления и концентрации. Диаграмма есть наглядное отображение устойчивых фаз при комнатной температуре. Мера устойчивости фаз определяется законом Гиббса или правилом фаз. Правило фаз устанавливает связь между числом степеней свободы, числом фаз и компонентов. Под числом степеней свободы понимают число внешних и внутренних факторов, которые можно изменять без изменения числа фаз в системе.
Диаграмма состояния представляет собой графическое отображение состояния сплава в зависимости от температуры, давления и концентрации. Диаграмма есть наглядное отображение устойчивых фаз при комнатной температуре. Мера устойчивости фаз определяется законом Гиббса или правилом фаз. Правило фаз устанавливает связь между числом степеней свободы, числом фаз и компонентов. Под числом степеней свободы понимают число внешних и внутренних факторов, которые можно изменять без изменения числа фаз в системе.
Правило фаз выполняется: с = к - ф + 2, где к – число компонентов, с – число степеней свободы, ф –число фаз, 2 – внешние факторы, т.е. изменяющаяся температура и давление, для сплавов принята несколько иная форма зависимости с = к -ф + 1 при условии постоянства давления.
 С учетом правила фаз, как объясняющего процесс кристаллизации, кристаллизацию металлов, которая протекает при постоянной температуре можно объяснить следующим образом:
С учетом правила фаз, как объясняющего процесс кристаллизации, кристаллизацию металлов, которая протекает при постоянной температуре можно объяснить следующим образом:
С12 =1-1+1=1 С2=1-2+1=0 С2`-3=1-1+1=1
Для двухкомпонентных систем, которые мы будем рассматривать в случае с=0 процесс будет происходить при постоянной температуре, при с=1 или с=2 с изменением температуры по времени.
 Диаграмма состояния для двух компонентной системы образует механическую смесь. Диаграмма состояния строятся в координатах температур (ось ординат) и концетрация компонентов (ось абсцисс).
Диаграмма состояния для двух компонентной системы образует механическую смесь. Диаграмма состояния строятся в координатах температур (ось ординат) и концетрация компонентов (ось абсцисс).
17. Диаграмма состояния для двухкомпонентной системы, образующая механическую смесь.

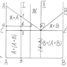 Диаграммы состояния строятся в координатах t-оси ординат и концентрация компонентов – ось абсцисс. Линия АДВ – линия ликвидус. а представляет собой геометрическое место точек соответствующих температурам, при которых из жидкости начинают выпадать кристаллы, следовательно выше линии ликвидус сплав находится в жидком состоянии. Линия СДЕ называется солидус. Она представляет собой геометрическое место точек, соответствующих температурам, при которых жидкая фаза исчезает, следовательно ниже линии солидус сплав находится в твердом состоянии. Между линиями ликвидус и солидус сплав находится в жидко- твердом состоянии, и чем ниже температура относительно линии ликвидус, тем больше кристаллов и меньше жидкой фазы в сплаве. В точке Д из жидкости одновременно начинают выпадать кристаллы компонентов (фаз). Для диаграмм этого типа компонент и фаза являются синонимами. Для диаграмм другого типа необходимо говорить только о фазах, поскольку компонент и фаза не являются синонимами. Механическая смесь, состоящая из двух или более фаз, одновременно кристаллизующаяся в жидкости называется эвтептикой. Ниже точки Д на диаграмме структура представляет собой чисто эвтептической.
Диаграммы состояния строятся в координатах t-оси ординат и концентрация компонентов – ось абсцисс. Линия АДВ – линия ликвидус. а представляет собой геометрическое место точек соответствующих температурам, при которых из жидкости начинают выпадать кристаллы, следовательно выше линии ликвидус сплав находится в жидком состоянии. Линия СДЕ называется солидус. Она представляет собой геометрическое место точек, соответствующих температурам, при которых жидкая фаза исчезает, следовательно ниже линии солидус сплав находится в твердом состоянии. Между линиями ликвидус и солидус сплав находится в жидко- твердом состоянии, и чем ниже температура относительно линии ликвидус, тем больше кристаллов и меньше жидкой фазы в сплаве. В точке Д из жидкости одновременно начинают выпадать кристаллы компонентов (фаз). Для диаграмм этого типа компонент и фаза являются синонимами. Для диаграмм другого типа необходимо говорить только о фазах, поскольку компонент и фаза не являются синонимами. Механическая смесь, состоящая из двух или более фаз, одновременно кристаллизующаяся в жидкости называется эвтептикой. Ниже точки Д на диаграмме структура представляет собой чисто эвтептической.
|
|
|
Правило отрезков.
Посредством правила отрезков можно определить состав фаз в любой двухфазной области и количественное их соотношение. Правило отрезков состоит из двух частей. Первая часть: для того чтобы определить состав фаз через заданную точку в двухфазной области (точка соответствует конкретной температуре) проводят горизонтальную линию до пересечения с линиями, ограничивающими эту область. Проекция точек пересечения на ось концентрации даст нам состав фаз. Вторая часть: для того чтобы определить количество фаз через заданную точку проводят горизонтальную линию до пересечения с линией, ограничивающей эту область. Отрезки между заданной точкой и точками с соответствующим составом фаз обратно пропорциональны их количеству.
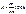
Правило фаз действует только в двухфазной области.
|
|
|


