 |
Протекание процесса окисления без стехиометрических коэффициентов можно представить следующей схемой
|
|
|
|
As2O3 + Me + H+ 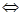 AsH3↑ + Men+ + H2O
AsH3↑ + Men+ + H2O
Определите, если такое возможно, сколько времени понадобится для оценки (обнаружения) наличия яда в веществе и в каком температурном интервале могут протекать данные процессы?
Исходные справочные данные
| Наименование матери ала | Диапазон температур, К | Эффективная константа скорости гетерогенного процесса k* | Энергия активации кинетической области Е акт(к), кДж/моль; | Энергия активации диффузионной области Е акт (д), кДж/моль; | РН раствора |
| Cu | 273-313 | От 0,037 до 25,65 | 131,56 | 14,85 | 6,15 |
| Ti | От 0,045 до 29,875 | 121,37 | 18,89 |
Решение
Сначала необходимо определить, какое из веществ – Cu или Ti – будет окисляться
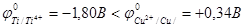
значит в реакции обнаружения мышьяка будет участвовать Ti. Что же тогда необходимо сделать?
1. Проверить возможность процесса разрушения титановой оболочки, протекающего по схеме:
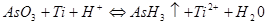
Титан является восстановителем (степень окисления изменяется от 0 до +4). Арсин является окислителем (степень окисления изменяется от +3 до -3). Таким образом, очевидно, что в данном случае этот процесс является окислительно-восстановительным.
Процесс окисления 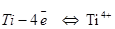 ,
,
Процесс восстановления 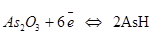 ,
,
Суммарный процесс, с учётом равенства коэффициентов будет выглядеть так:
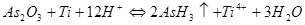 ,
,
а константа равновесия для суммарного процесса равна
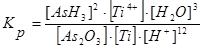 ,
,
где [AsH3] – равновесная концентрация арсина; [Ti4+] – равновесная концентрация ионов титана; [As2O3] – равновесная концентрация оксида мышьяка; [H2O] – концентрация воды (const); [Ti]- – равновесная концентрация титана;. [H+] – равновесная концентрация ионов водорода.
Окислителем, в данном случае, может быть и ион водорода [H+], так как рН=6,15 среды (по условию задачи) меньше 7. Процесс восстановления в данном случае описывается схемой
|
|
|
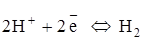 ;
;
Но, так как 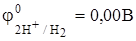 <
< 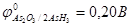 , то более вероятным окислителем является кислород, растворённый в водном растворе вина.
, то более вероятным окислителем является кислород, растворённый в водном растворе вина.
Если 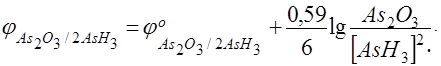 –
–
потенциал катодного процесса, а
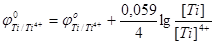
потенциал анодного процесса, тогда условие равновесия будет выглядеть следующим образом
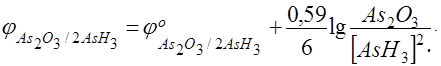 =
= 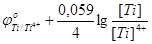 .
.
После преобразования данного соотношения можно записать
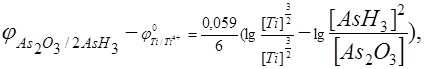
или 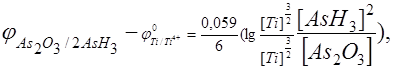 ,
,
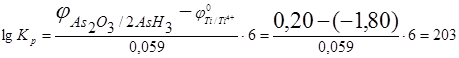
Константа равновесия равна
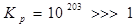
При подстановке в выражения энергии Гиббса
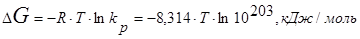
можно предположить, что протекание процесса разрушения титана вероятно, так как Kp >1.
2. Для нахождения температурного интервала протекание процесса диффузии и кинетики по исходным данным необходимо построить графическую зависимость lgk* от 1/Т.
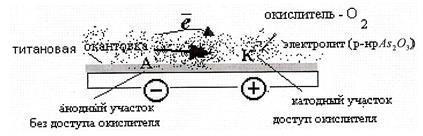
Схема процесса разрушения (окисления) титана выглядит следующим образом
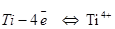 .
.
При построении графической зависимости lgk* от 1/Т производятся следующие расчёты. По исходным данным энергии активации и температуре определяются углы a1 для построения прямой кинетической области и a2 – для диффузионной
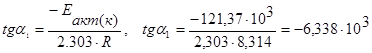 ,
,
или –tga1=tg(180-a1)= 6,338·103, тогда угол (180–a1) = 81,04о, a1=98,96о.
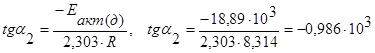 ,
,
или –tga2=tg(180-a2)=0,986·103,
тогда угол (180-a2) = 44,61о, a2=135,39о
По графической зависимости (рис.2) возможно определить температурные интервалы кинетической области, который начинается с температуры 279,3 К и ниже (рис. кривая 1), а температурный интервал диффузионной области начинается с температуры 282,5 К и выше (кривая 2).
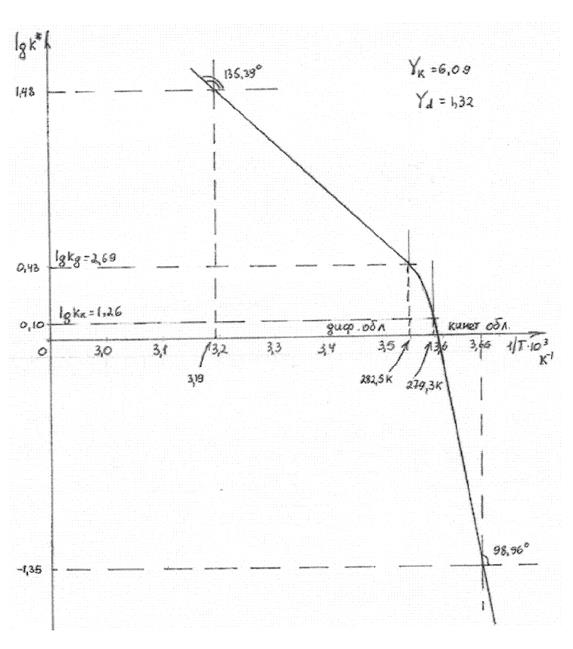
Рис. 1. Зависимость lgk* от 1/T для гетерогенного процесса разрушения
Температурный коэффициент кинетической области равен
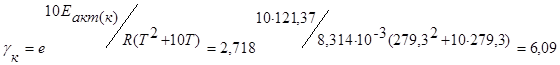
При этом kк* – эффективная константа скорости гетерогенного процесса кинетической области равна – (lgkк*=0,1 по графику зависимость lgkк* от 1/T), а kк*= 1,26 см/с.
Скорость кинетического процесса начиная с температуры 279,3К (температурная граница протекания процесса взаимодействия – кинетическая область) будет равна:
|
|
|
для процесса 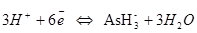
Vк= kк*·[О2]×[H2O]2 = 1,26·[0,21]×[55,56]2∙10-3=0,817  .
.
Так как толщина окантовки из титана составляла 30 мкм (3×10-5 см), то данная оболочка разрушится за 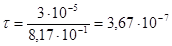 секунд (то есть практически мгновенно).
секунд (то есть практически мгновенно).
|
|
|
12 |


