 |
Химические свойства азотной кислоты (взаимодействие с неметаллами)
|
|
|
|
Химические свойства азотной кислоты (взаимодействие с металлами)
HNO3 (конц)
Li K Ca Na Mg (Al) Mn Zn (Cr) (Fe) Ni Sn Pb H Cu Hg Ag (Аu Pt)
соль + N2O + H2O Соль + NO2 + H2O не реагируют
1). При взаимодействии с металлами никогда не выделяется водород
2). Al, Cr, Fe пассивируются (покрываются защитной пленкой) концентрированной холодной азотной кислотой, поэтому реагируют только при нагревании:
Fe + 6HNO3(конц) 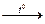 Fe(NO3)3 + 3NO2 + 3H2O
Fe(NO3)3 + 3NO2 + 3H2O
HNO3 (разбавленная)
Li K Ca Na Mg Al Mn Zn Cr Fe Ni Sn Pb H Cu Hg Ag (Аu Pt)
соль + N2 + H2O Соль + NO + H2O не реагируют
HNO3 (очень разбавленная)
Li K Ca Na Mg Al Mn Zn Cr Fe Ni Sn Pb H Cu Hg Ag (Аu Pt)
соль + NH4NO3 + H2O не реагируют
Химические свойства азотной кислоты (взаимодействие с неметаллами)
Азотная кислота восстанавливается до NO2; неметаллы окисляются до соответствующих кислот:
S0 + 6HNO3(конц) → H2S+6O4 + 6NO2 + 2H2O (нагревание)
B0 + 3HNO3 →H3B+3O3 + 3NO2
P0 + 5HNO3 →5NO2 + H3P+5O4 + H2O
I2+10HNO3(к) ®2HIO3+10NO2 ↑+4H2O
C + 4HNO3 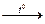 4NO2 + CO2 + 2H2O
4NO2 + CO2 + 2H2O
Разбавленная кислота окисляет только фосфор и йод:
3P0 + 5HNO3 + 2H2O(разб) →5NO + 3H3P+5O4
3I2+10HNO3(разб) ®6HIO3+10NO↑+2H2O
Азотная кислота окисляет сложные вещества; при этом может происходить окисление одного из элементов: FeO + 4HNO3(конц) ®Fe(NO3)3 + NO2 + 2H2О
или двух атомов одновременно: Cu+12S-2 + 14HNO3(конц) → 2Cu+1(NO3)2 + H2S+6O4 + 10NO2↑+ 6H2O
В реакциях между сложными веществами и азотной кислотой, как правило, выделяется NO2, а с разбавленной – NO.
Хлорид и фторид-ионы не окисляются азотной кислотой; бромид и йодид-анионы окисляются до свободных галогенов, азотная кислота восстанавливается до NO (разбавленная) и до NO2 – концентрированная.
Процессы, происходящие в «царской водке».
HNO3 (конц) + 3HCl (конц) ↔NOCl + 2Cl0 + 2H2O (комн. темп)
2HNO3 (конц) + 6HCl (конц)→2NO + 3Cl2 + 4H2O
HNO3 (конц) + 4HCl (конц) + Au →H[AuCl4] + NO + 2H2O
|
|
|
4HNO3 (конц) + 18HCl (конц) + 3Pt →3H2[PtCl6] + 4NO + 8H2O
NOCl – оранжево–желтый газ, желтовато–красная жидкость, термически неустойчивое вещество, разлагается при комнатной температуре:
2NOCl ↔2NO + Cl2 Сильно корродирует металлы: 3NOCl + Fe → FeCl3 + 3NO (при комн. темп.)
2 вариант лекции
Азотная кислота (HNO3)
взаимодействие с металлами
Сильный окислитель
1. Разлагается на свету и при нагревании 4HNO3  2H2O + 4NO2 + O2
2H2O + 4NO2 + O2
2. Окрашивает белки в оранжево-желтый цвет (при попадании на кожу рук - "ксантопротеиновая реакция")
3. При взаимодействии с металлами никогда не выделяется водород
металл + HNO3 → соль азотной кислоты + вода + газ (азот, оксиды азота, аммиак, который в избытке кислоты образует нитрат аммония).
в) HNO3 – окислитель.
Продукты восстановления HNO3 зависят от 2-х факторов: силы восстановителя и концентрации кислоты. Чем сильнее восстановитель и чем более разбавлена кислота, тем более низкую степень окисления имеет азот (N) в продуктах восстановления HNO3:
| восстановитель концентрация HNO3 | щелочные и щелочноземельные металлы, магний, цинк | тяжелые металлы |
| концентрированная кислота (более 67%) | N2+1O | N+4O2 |
| разбавленная кислота (менее 67, более 10%) | N2 | N+2O |
| Очень разбавленная кислота (менее 10%); реагирует только с металлами, стоящими до водорода в ряду активности. | N–3H4NO3 | N–3H4NO3 |
HNO3 не взаимодействует с Au, Pt, Ir, Os.
HNO3(конц.) взаимодействует с Al, Cr, Fe ТОЛЬКО при t°
NO3- + 2H+ + 1e → NO2 + H2O, (1)
NO3- + 4H+ + 3e → NO + 2H2O, (2)
2NO3- + 10H+ + 8e → N2O + 5H2O, (3)
2NO3- + 12H+ + 10e → N2 + 6H2O, (4)
NO3- + 10H+ + 8e → NH4+ + 3H2O. (5)
***С одним и тем же восстановителем, например цинком, кислота, если она концентрированная, будет обязательно реагировать по схеме (1) с выделением NО2; если НNО3 разбавленная, то она может взаимодействовать с Zn по любой схеме (2)-(5), в зависимости от степени разбавления.
Взаимодействие концентрированной азотной кислоты с металлами:
|
|
|
 | |||||
 | |||||
 | |||||
Li K Ca Na Mg Al Mn Zn Cr Fe Ni Sn Pb H Cu Hg Ag Au Pt
 |  |
* соль + N2O + Н2О ** соль + NO2 + H2O
1). Al, Cr, Fe пассивируются концентрированной кислотой (покрываясь защитной пленкой из хемосорбированного кислорода), однако при нагревании реакции с этими металлами протекают:
Fe + 6HNO3 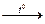 Fe(NO3)3 + 3NO2↑ + 3H2O
Fe(NO3)3 + 3NO2↑ + 3H2O
2). * Щелочные и щелочноземельные металлы реагируют с концентрированной кислотой со взрывом, при этом продукты восстановления кислоты могут быть самыми разнообразными (вплоть до NO2). [для ЕГЭ пишем N2O или азот]
3). ** Металлы из середины ряда активности, а также некоторые металлы, стоящие после Н2, при взаимодействии с концентрированной кислотой в качестве продукта восстановления азота образовывают NO2.
4). Благородные металлы (Au, Pt, Os, Ir и др.) не растворяются в азотной кислоте.
Взаимодействие разбавленной азотной кислоты с металлами:
Li K Ca Na Mg Al Mn Zn Cr Fe Ni Sn Pb H Cu Hg Ag Au Pt
 |  |
* соль + N2 + Н2О ** соль + NO + H2O
|
|
|


