 |
Подготовка исходных данных по топливному газу и водяному пару
|
|
|
|
Таблица 2
| Состав газа, %об | Давление (изб), МПа | Барометрическое давление, кПа | Температура газа, 0С | Расход газа при н.у., м3/ч | ||||
| СН4 | С2Н6 | С3Н8 | С4Н10 | N2 | ||||
| 98,3 | 0,30 | 0,10 | 0,20 | 1,10 | 0,120 | 100,0 | 10 | 2300 |
Свойства топливного газа
Таблица 3
| Компонент | Мольная доля (yi) | Молярная масса (Мi), кг/кмоль |
| метан | 0,983 | 16 |
| этан | 0,003 | 30 |
| пропан | 0,001 | 44 |
| бутан | 0,002 | 58 |
| азот | 0,011 | 28 |
1) Расчёт абсолютного и парциальных давлений компонентов топливного газа:
Рабс = Рбар + Ризб = 0,12*106 + 100*103=0,22*106 Па = 2,2426ата = 2,2426кгс/см2;
Парциальные давления:
Р(метан) = Рабс*у(метан) = 0,983* Рабс = 216,26кПа = 2,2045ат;
Р(этан) = Рабс*у(этан) = 0,003* Рабс = 0,66кПа = 0,0067278ат;
Р(пропан) = Рабс*у(пропан) = 0,001* Рабс = 0,22кПа = 0,0022426ат;
Р(бутан) = Рабс*у(бутан) = 0,002* Рабс=0,44кПа = 0,00448522ат;
Р(азот) = Рабс*у(азот) = 0,011* Рабс = 2,42кПа=0,0246687ат.
2) Абсолютная температура газа:
Т = Т0+t = 273+10 = 283К
3) Определение плотности и удельного объёма газа при н.у.
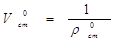 ;
;  ;
; 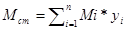 ;
;
где yi – мольная доля компонента в смеси;
Mi – молярная масса i–го компонента;
Mcm – молярная масса смеси;
cm – плотность смеси при н.у.;
V0cm – удельный объем смеси при н.у..
Мсм = 0,983*16+0,003*30+0,001*44+0,002*58+0,011*28 = 16,286 кг/кмоль;
cm = 16,286/22,4 = 0,727 кг/м3;
v0cm =1/cm =1,375м3/кг.
4) Определение массовах концентраций компонентов:
ŷ(метан) = у(метан)*М(метан)/Мсм=0,983*16/16,286=0,966;
ŷ(этан) = у(этан)*М(этан)/Мсм = 0,003*30/16,286=0,0055;
ŷ(пропан) = у(пропан)*М(пропан)/Мсм = 0,001*44/16,286=0,0027;
ŷ(бутан) = у(бутан)*М(бутан)/Мсм = 0,002*58/16,286=0,0071;
ŷ(азот) = у(азот)*М(азот)/Мсм=0,011*28/16,286=0,0187.
5) Определение расхода газа при рабочих условиях:
GP,T = G0*P0*T/P*T0 = 2300*105*283/0,22*106*273 = 1083,75 м3/ч
Определение свойств водяного пара
Известно, что
производительность печи по водяному пару G=4,03кг/с
|
|
|
давление пера на входе Р1=0.5 МПа ≈ 5 бар = 5,1ат
температура пара на входе в печь t1=151ºС
температура пара на выходе из печи t2=550ºС
Рассчитаем температуру кипения:
ts=100* 4√p=150,2ºC
По таблице Вукаловича определяем свойства кипящей воды и сухого насыщенного пара:
Таблица 4
| t,ºC | Р=5 бар | ||
| 550 | ts=151,85 V`=0.0010928 V”=0.37481 h`=640,1 h”=2748,5 S`=1,8604 S”=6.8215 | ||
| V | h | S | |
| 0.7575 | 3594.7 | 8.2222 | |
Изменение энтальпии: Δh=h-h”=3594.7-2748.5=846.2кДж/кг
ΔН=GΔh=4,03*846,2= 3410,186кДж/с – изменение энтальпии, приходящееся на 4,03кг.
Изменение энтропии: Δs=s-s”=8.2222-6.8215 =1,4007кДж/кг*град
ΔS=Δs*G=4,03*1,4007=5,645кДж/град*с
Изменение внутренней энергии:ΔU=Cv(T2-T1)
Cv=Cp-R
Tср=(Т1+Т2)/2=(151+550)/2=350,50С=623,5К
Ср=1,67+0,63*10-3*Т=2,063кДж/кг*К
Cv=2,063 -8,314*10-3/18=0,114кДж/кг*К
Δu=0,114*(550-151)=45,486 кДж/кг
ΔU=GΔu=4,03*45,486=183,31кДж
Расчётным методом определим энтальпию перегретого пара и сравним её значение с табличным.
h=2547,668-55,64*4√р+tпп(1,8334-0,0311*4√р)+0,000311*t2пп
h=2547,668+55,64*1,503 +550* (1,8334-0,0311*1,503)+0,000311*5502 = 3557.366 кДж/кг
Ошибка: 100*(3594.7-3557.366)/3594.7 =1%
Ошибка по температуре кипения: 100*(151.85-150.2)/151.85 =0.44%
Расчет процесса горения в печи
Определение основных характеристик топлива
Таблица 5.
| Компонент топлива | Низшая теплота сгорания Qрн, МДж/кг |
| Метан | 35,84 |
| Этан | 63,8 |
| Пропан | 86,06 |
| Бутан | 118,73 |
Низшая теплота сгорания топлива Qрн = SQрнi*yi
Qрн = 35.84*0.983+63.8*0.003+86.06*0.001+118.73*0.002=35.746 МДж/м3
`Qрн = 35,746/r = 35,746/0,727 = 49,169 МДж/кг
Определение элементного состава топлива
Содержание углерода C = 12.01* Sni*yi/Mт;
содержание водорода Н = 1,008*Sni*yi/Mт;
содержание азота N = 14,01*Sni*yi/Mт;
где ni – число атомов i- го элемента,
yi – мольная доля i- го компонента топлива,
Мт – молярная масса топлива.
C = 12.01*(1*98.3+2*0.3+3*0.1+4*0.2)/16.286 = 73.744%
H = 1.008*(4*98.3+6*0.3+8*0.1+10*0.2)/16.286 = 24.621%
N = 14.01*(1.1*2)/16.286 = 1.635%
C+H+N = 73.744+24.621+1.635 = 100%
Расчет процесса горения
 |
Топливо
|
|
|
 CO2
CO2
|
 H2O
H2O
 Воздух N2
Воздух N2
 O2
O2
Рис.2. Схема топки
1) Теоретический расход воздуха
L0 = 0.115*C+0.345*H+0.043*(S-O),
где C,H,O,S – содержание элементов, %.
0 = 0,115*73,744+0,345*24,621=16,975 кг/кг.
2) Действительный расход воздуха
Lд = a*L0, где a - коэффициент избытка воздуха.
Lд = 1,05*16,975 = 17,824 кг/кг.
3) Количество продуктов сгорания
m(CO2) = 0.0367*C = 0.0367*73.744=2.706;
m(H2O) = 0.09*H = 0.09*24.621 = 2.216;
m(N2) = 0.768*a*L0+0.01*N = 0.768*1.05*16.975+0.01*1.635 = 13.705;
m(O2) = 0.232*(a-1)*L0 = 0.196.
Таким образом, mnc=åmi = 2.706+2.216+13.705+0.196 = 18.823;
или mnc= 1+Lд = 1+17.824 = 18.724.
Рассчитаем объем продуктов сгорания Vnc, а также содержание каждого компонента в массовых (`yi) и объемных (yi’) долях по формулам:
Vnc=åVi; Vi = mi*22.4/Mi;
`yi = mi*100/mnc; yi’ = Vi*100/Vnc.
Результаты расчетов приведены в таблице 6.
Таблица 6.
| Наименование | CO2 | H2O | N2 | O2 | сумма |
| масса i-го компонента | 2,706 | 2,216 | 13,705 | 0,196 | 18,823 |
| мас.%, yi | 14,376 | 11,773 | 72,81 | 1,041 | 100 |
| объем i-го компонента | 1,378 | 2,758 | 10,964 | 0,137 | 15,236 |
| об.%, yi' | 9,041 | 18,099 | 71,959 | 0,9 | 100 |
4) Расчет энтальпии продуктов сгорания осуществляется по формуле:
`Hnc = t*å`Cpi*mi,
где t- температура, 0С,
Срi – теплоемкость i-го компонента, кДж/кг*К,
mi - масса i-го компонента, кг.
Результаты расчетов приведены в таблице 7.
Таблица 7.
| t, 0C | 151 | 210 | 450 | 650 | 750 | 850 | 916,39 |
| `Cpm,кДж/кг*К | 20,229 | 21,097 | 22,280 | 22,599 | 22,695 | 22,768 | 22,807 |
| `Нпс | 3054,646 | 4430,29 | 10026,13 | 14689,33 | 17020,93 | 19352,53 | 20900,48 |
|
|
|
12 |


