 |
Синтез 2-диазоиндандиона-1,3
|
|
|
|
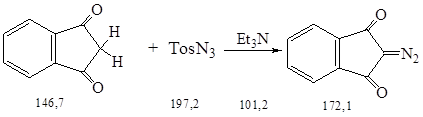
Синтез осуществляли по методике 2.3.
Суспензию 10,0 г (0,07 моль) тонкоизмельченного, охлажденного до –12 0С индандиона-1,3 в 60 мл безводного этанола прибавили при перемешивании к 9,0 г (0,09 моль) безводного триэтиламина; при этом температура поднимается до 4 0С. После повторного охлаждения к красно-коричневому раствору прилили 20,2 г (0,10 моль) п -тозилазида и смесь перемешали при охлаждении еще 1 ч.
Смесь отфильтровали, остаток на фильтре промыли охлажденным до –100С этанолом и после перекристаллизации из этанола получили 7,3 г (62 %) диазокетона в виде желтых игл.
Результаты анализа полученного вещества:
Тпл. = 147 0С
ИК (KBr): 2130, 2115 (С=N2), 1675 см-1 (С=О).
Синтез трет-бутилгипохлорита

Синтез осуществляли по методике 2.4.
В двухгорлую круглодонную колбу объемом 250 мл поместили 100 мл NaOH (10 %) и прикапывали при перемешивании и охлаждении 7,4 г трет -бутанола. Затем смесь хлорировали около 30 мин., контролируя температуру, которая не должна подниматься выше 100С. Образовавшееся желтое масло отделили на делительной воронке и промыли холодной водой. Получили 5 г (46%) продукта с Ткип. = 77–78 0С.
Необходимый для синтеза хлор получили путем взаимодействия твердого перманганата калия с концентрированной соляной кислотой по методике, описанной в [7]. К 10 г твердого KMnO4, помещенного в колбу с отводом, прибавили по каплям из капельной воронки НСlконц. Поток полученного хлора осушали последовательно двумя промывалками с концентрированной серной кислотой, колонкой с безводным хлоридом кальция и колонкой с оксидом фосфора. После этого поток сухого хлора ввели в колбу со смесью гидроксида натрия и трет -бутанола (перед промывалками с серной кислотой необходимо поставить пустую обратную промывалку во избежании попадания серной кислоты в сосуд с перманганатом калия). Выход в атмосферу из колбы был защищен трубкой с безводным хлоридом кальция.
|
|
|
Синтез 2,2-диэтоксииндандиона-1,3

Синтез проводили по методике 2.6.
К суспензии 7,0 г (0,04 моль) тонкоизмельченного 2-диазоиндандиона-1,3 (см. п. 3.3.) в 60 мл этанола прикапали при перемешивании и охлаждении льдом 4,7 г (0,04 моль) трет -бутилгипохлорита (см. п. 3.4.) с такой скоростью, чтобы температура реакционной смеси не превышала 15 0С.
Вскоре из прозрачного раствора выпадают желтые кристаллы, которые через 30 мин. отсосали. Концентрирование маточного раствора при 30 0С/12 мм рт. ст. дало еще некоторое количество продукта. После перекристаллизации всех фракций из этанола получили 6,9 г (72 %) бледно-желтого кеталя с Тпл. = 84 0С.
Результаты анализа полученного вещества:
Тпл. = 84 0С
ИК (KBr): 1750, 1720 см-1 (С=О).
Обсуждение результатов
В результате проделанной работы был осуществлен ретросинтетический анализ и синтезирован 2,2-диэтоксииндандион-1,3 по следующей схеме:
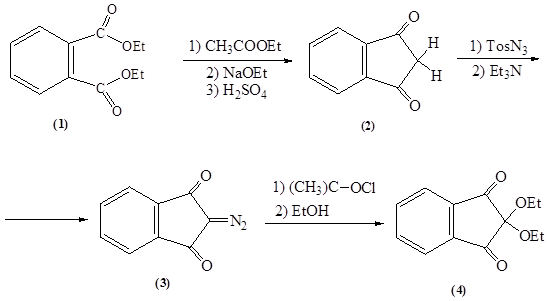
1 стадия: реакция образования пятичленного цикла сложноэфирной конденсацией этилового эфира уксусной кислоты с диэтиловым эфиром фталевой кислоты в присутствии сильного основания. Дальнейший гидролиз в-кетоэфира и декарбоксилирование образовавшейся в-кетокарбоновой кислоты.
Выход: 65 %.
2 стадия: реакция переноса диазогруппы путем взаимодействия индандиона-1,3 с п -толуолсульфонилазидом в присутствии основанияю
Выход: 62 %.
3 стадия: реакция гидролиза 2-диазоиндандиона-1,3 в присутствии окислителя с образованием 2,2-диэтоксииндандиона-1,3.
Выход: 72 %.
Выводы
1. На основании литературных данных был спланирован синтез 2,2-диэтоксииндандиона-1,3.
2. Освоена методика ретросинтетического анализа.
3. Был проведен трехстадийный синтез 2,2-диэтоксииндандиона-1,3, в результате которого выход целевого продукта составил 72 %. Полученное вещество было охарактеризовано и подтверждено данными ИК-спектроскопии.
|
|
|
4. Выходы веществ на всех стадиях были меньше, чем по литературным методикам, что было связано, по-видимому, с недостаточной очисткой исходных реагентов и потерями при очистке полученных веществ.
Список использованной литературы
1. Ленинджер А. Основы биохимии; В 3 т. М.: Мир, 1985.
2. Teeter W.O., Shuner R.L.// The Jornal of the American Chemical Society, 1933, vol. 55, p. 3036.
3. Regitz M., Hocker J., Liednegener A.// Organic Synthesis, 1968, vol. 48.
4. Regitz M., Schwall H., Heck G., Eistert B., Bock G.// Liebigs Annalen Chemie, 1965, vol. 690, p. 125.
5. Teeter H.M., Bell E.W.// Organic Synthesis, 1952, vol. 32, p.20.
6. Regitz M., Adolph H.-G// Chemische Berichte, 1968, vol. 101, p. 3604.
7. Практикум по неорганической химии/ Под. Ред. В.П. Зломанова. М., 1994, 320 с.
|
|
|
12 |


