 |
Мономолекулярное нуклеофильное замещение
|
|
|
|
Третичные алкилгалогениды реагируют по механизму SN1 (мономолекулярное нуклеофильное замещение).

Cтадии процесса. Реакция протекает в две стадии. Первая стадия - гетеролитический разрыв связи углерод-галоген - медленная.

Вторая стадия - образовавшийся карбокатион практически мгновенно взаимодействует с нуклеофилом – молекулой воды.

В отличие от механизма SN2 разрыв связи С-Х и образование новой связи С-Nu протекает не одновременно, а последовательно.
Энергетическая диаграмма реакции изображает изменение потенциальной энергии в ходе двух стадийного мономолекулярного замещения.
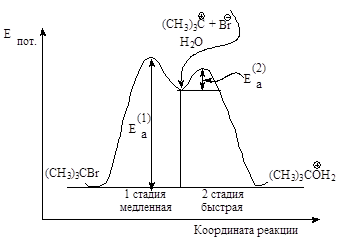
Рис.2.4. График изменения потенциальной энергии в ходе мономолекулярного нуклеофильного замещения. SN1-двухстадийный последовательный процесс.
Скорость реакции. В медленной стадии, определяющей скорость реакции, принимает участие только одна молекула, поэтому механизм называют мономолекулярным замещением. Скорость реакции зависит от концентрации галогеналкана и определяется по формуле V = K[R-Hal].
Концентрация нуклеофильного реагента. Низкая концентрация нуклеофила способствует SN1-реакции.
Перегруппировка. В медленной стадии реакции образуется карбокатион - частица, способная к перегруппировке. Галогеналканы могут реагировать по механизму SN1 через стадию перегруппировки первоначально образующегося карбокатиона: если в результате 1,2-сдвига отрицательно заряженной частицы образуется более устойчивый карбокатион, то происходит перегруппировка.

Перегруппировка считается признаком SN1-механизма.
Растворитель. Переходное состояние SN1-реакции более полярно, чем исходное состояние. Увеличение полярности растворителя способствует большей сольватации переходного состояния по сравнению с сольватацией исходного соединения. Это приводит к росту скорости реакции.
|
|
|
При проведении SN1-реакции используют протонные растворители с высокой диэлектрической проницаемостью, способные образовывать водородные связи.


Рис.2.5. Влияние полярности растворителя на скорость реакции мономолекулярного нуклеофильного замещения
В растворителе, имеющем высокую диэлектрическую проницаемость, легче протекает ионизация галогеналкана, но, в отличие от апротонных растворителей, в протонном сольватируется не только карбокатион, но и ион галогена, образуя с ним водородные связи.

Сольватация сопровождается выделением значительного количества энергии, которая может быть затрачена на ионизацию новых исходных молекул, что приводит к ускорению реакции.
Сольватация нуклеофила не влияет на скорость реакции, так как даже стабилизированный сольватацией нуклеофил быстро реагирует с карбокатионом.
Стереохимия. В карбокатионе, образующемся в медленной стадии, связи sp 2 -гибридизованного атома углерода расположены в одной плоскости. Если SN1-замещение протекает у хирального атома углерода, то образующийся плоский карбокатион становится ахиральным.
Последующая атака нуклеофильного реагента происходит с одинаковой вероятностью и с той и с другой стороны плоского карбокатиона. Следовательно, половина образующихся молекул будет иметь ту же конфигурацию, что и исходное соединение, а половина - будет его зеркальным изображением, т.е. образуется эквимолекулярная смесь энантиомеров - рацемат. Такая реакция приводит к оптически неактивному продукту.


В том случае, если уходящий галогенид-ион не успевает отойти от реакционного центра, он затрудняет атаку нуклеофила со своей стороны. Это приводит к образованию большего количества изомера с конфигурацией, противоположной конфигурации исходного соединения. Тогда имеет место частичная рацемизация.
|
|
|
Реакционная способность. Главным фактором, определяющим реакционную способность в SN1-реакции, является электронный фактор - устойчивость образующегося в медленной стадии реакции карбокатиона. Чем устойчивее карбокатион, тем легче он образуется, тем быстрее протекает замещение.


2.1.3. Сравнение реакций SN 1 и SN 2
Каждый из этих механизмов в чистом виде встречается очень редко. Реакционная способность в SN2-реакции уменьшается при переходе от СН3-Х к первичным RCH2-X, для вторичных - она гораздо меньше и появляется значительный вклад SN1-реакций. При переходе от вторичных к третичным галогеналканам реакционная способность в SN1-реакции резко возрастает.

Изменяя условия протекания реакций, можно направить процесс преимущественно по тому или иному механизму.
Таблица 2.2
Влияние условий реакции на относительное значение двух механизмов
| Механизм | Растворитель | Сила нуклеофила | Концентрация нуклеофила |
| SN1 | Протонный | Более слабый | Меньшая |
| SN2 | Апротонный | Более сильный | Бóльшая |
|
|
|


