 |
Катодная поляризация при электроосаждении металлов
|
|
|
|
Методика эксперимента. Простейшая электролитическая ячейка, которая может быть использована для снятия поляризационных кривых, представлена на рис. 2.5 [7].
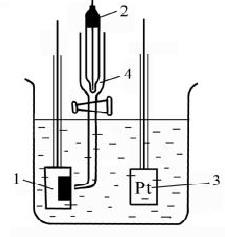
Рис. 2.5. Ячейка для снятия поляризационных кривых: 1 - рабочий электрод; 2 – электрод сравнения; 3 - вспомогательный электрод; 4 - электролитический ключ.
В ячейку заливали 80 - 120 мл рабочего раствора. Во фторопластовой крышке закрепляли исследуемый (металлический) и вспомогательный (графитовый) электроды, а также электролитический ключ. Кончик электролитического ключа должен быть направлен к поверхности электрода и находиться на расстоянии 0,5-1,0 мм от нее, чтобы свести к минимуму вклад омического падения напряжения в растворе в величину измеряемого напряжения Еизм между рабочим электродом и электродом сравнения. С помощью резиновой груши электролитический ключ заполняли рабочим раствором, а в его верхнюю часть помещают электрод сравнения.
Вспомогательный электрод закрепляли на уровне исследуемого электрода напротив его рабочей поверхности. Перед опытом поверхность рабочего электрода тщательно зачищали наждачной бумагой, обезжиривали спиртом или ацетоном и промывали дистиллированной водой. Площадь поверхности электродов определяли до проведения эксперимента.
Рабочий электрод выдерживали в растворе 5-10 мин, измеряли и записывали его равновесный или стационарный потенциал. После этого включали питание гальваностата и тумблером "Поляризация " определяли направление поляризации – «катодная». С помощью ручек "Ток грубо" и "Ток точно" устанавливали начальное минимальное значение тока. Фиксировали его на миллиамперметре и записывают в таблицу. После достижения стационарного состояния, обычно 1-2 минуты, измеряли потенциал рабочего электрода относительно электрода сравнения (Еизм) и также заносили его в таблицу.
|
|
|
Исходными экспериментальными данными служат величина поляризующего тока I (используемого для расчета плотности тока i по формуле: i = I/S, где S - поверхность электрода) и потенциал рабочего электрода Eизм. Зная потенциал электрода сравнения, рассчитывали потенциал рабочего электрода относительно стандартного водородного электрода Е = Eизм + Eсравн. По экспериментальным данным строили катодные гальваностатические кривые в координатах Е – i и E – lgi.
Результаты и обсуждение. На рис. 2.6 представлена катодная кривая на меди в растворе 0,1 М CuSO4.
|
|
|

Рис. 2.6. Катодная гальваностатическая кривая меди в 0,1 М CuSO4
В области потенциалов 1 протекает процесс восстановления кислорода: О2 + 4Н+ +4е- → 2Н2О. При сдвиге потенциала в отрицательную область (примерно 190 мВ) начинается другой процесс – восстановление меди Cu2+ +2e- → Cu0↓. Наблюдается резкое повышение плотности тока, что свидетельствует о значительном увеличении скорости катодного процесса. При потенциале -800 мВ скорость восстановления возрастает дополнительно, видимо, из-за протекания катодного выделения водорода 2Н+ +2е- →Н2
СТРАНИЦЫ 17 И 18 НЕ ДОСТУПНЫ ДЛЯ ПРОСМОТРА
СТРАНИЦЫ 17 И 18 НЕ ДОСТУПНЫ ДЛЯ ПРОСМОТРА
ВЫВОДЫ
1. Удельная и молярная электропроводность рабочих растворов изменяется в пределах от 18 до 6 Ом-1см-1 и от 214 до 68 Ом-1см2моль-1 соответственно. При этом добавление кислоты к раствору сульфата мели повышает электропроводность, а при добавлении спирта к этому раствору электропроводность падает.
2. Кислотность рабочих растворов изменяется от 1,3 до 5,3, при этом самое низкое значение соответствует рабочему раствору 0,05 М CuSO4 + 0,05 M H2SO4 + 1г/л C3H7OH, а самое высокое – 0,1 М ZnSO4. Добавление кислоты к раствору сульфата меди значительно понижает рН раствора.
|
|
|
3. При электролизе исследуемых водных растворов солей металлов происходит три параллельных катодных процесса: восстановление кислорода, восстановление металла, восстановление водорода. В растворах сульфата меди кислород восстанавливается в интервале потенциалов от 70 мВ до 300 мВ. Добавление серной кислоты не изменяет режим восстановления кислорода, а добавление изопропилового спирта значительно затрудняет катодное выделение меди.
|
|
|
12 |


