 |
Позитронная эмиссионная томография
|
|
|
|
Позитронная эмиссионная томография (ПЭТ) — относительно новый и высокоинформативный неинвазивный метод исследования метаболизма сердечной мышцы, поглощения кислорода и коронарной перфузии. Метод основан на регистрации лучевой активности сердца после введения специальных радиоактивных меток, которые включаются в те или иные обменные процессы (гликолиз, окислительное фосфорилирование глюкозы, β-окисление жирных кислот и т.д.), имитируя “поведение” основных метаболических субстратов (глюкозы, жирных кислот и т.п.).
У больных ИБС метод ПЭТ позволяет неинвазивным способом изучать региональный миокардиальный кровоток, метаболизм глюкозы и жирных кислот, поглощение кислорода. ПЭТ оказалась незамененимым методом в диагностике жизнеспособности миокарда. Так например, когда нарушение локальной сократимости ЛЖ (гипокинезия, акинезия) обусловлено гибернирующим или оглушенным миокардом, сохранившим свою жизнеспособность, при ПЭТ можно зарегистрировать метаболическую активность данного участка сердечной мышцы (рис. 5.32), тогда как при наличии рубца такая активность не выявляется.
| Рис. 5.32. Результаты позитронной эмиссионной томографии (ПЭТ) у больного ИБС до (а) и после (б) применения антиангинальных лекарственных средств. Наблюдается значительное увеличение окисления глюкозы в ишемизированном миокарде ЛЖ, сохранившем жизнеспособность | 
|
Эхокардиография
Эхокардиографическое исследование у больных ИБС позволяет получить важную информацию о морфологических и функциональных изменениях в сердце. С помощью эхокардиографии (ЭхоКГ) диагностируют:
- нарушения локальной сократимости ЛЖ, обусловленные снижением перфузии отдельных сегментов ЛЖ во время нагрузочных тестов (стресс-эхокардиография);
- жизнеспособность ишемизированного миокарда (диагностика “гибернирующего” и “оглушенного” миокарда);
- постинфарктный (крупноочаговый) кардиосклероз и аневризму ЛЖ (острую и хроническую);
- наличие внутрисердечного тромба;
- наличие систолической и диастолической дисфункции ЛЖ;
- признаки застоя в венах большого круга кровообращения и (косвенно) — величину ЦВД;
- признаки легочной артериальной гипертензии;
- компенсаторную гипертрофию миокарда желудочков;
- дисфункцию клапанного аппарата (пролабирование митрального клапана, отрыв хорд и папиллярных мышц, и др.);
- изменение некоторых морфометрических параметров (толщины стенок желудочков и размеров камер сердца);
- нарушение характера кровотока в крупных КА (некоторые современные методики ЭхоКГ).
Получение столь обширной информации возможно только при комплексном использовании трех основных режимов эхокардиографии: одномерного (М-режима), двухмерного (В-режима) и допплеровского режима.
|
|
|
Оценка систолической и диастолической функции левого желудочка
Систолическая функция ЛЖ. Основными гемодинамическими показателями, отражающими систолическую функцию ЛЖ, являются ФВ, УО, МО, СИ, а также конечно-систолический (КСО) и конечно-диастолический (КДО) объемы ЛЖ. Эти показатели получают при исследовании в двухмерном и допплеровском режимах по методике, подробно описанной в главе 2.
Как было показано выше, наиболее ранним маркером систолической дисфункции ЛЖ является уменьшение фракции выброса (ФВ) до 40–45% и ниже (табл. 2.8), которое обычно сочетается с увеличением КСО и КДО, т.е. с дилатацией ЛЖ и его объемной перегрузкой. При этом следует иметь в виду сильную зависимость ФВ от величины пред- и постнагрузки: ФВ может уменьшаться при гиповолемии (шок, острая кровопотеря и т.д.), уменьшении притока крови к правому сердцу, а также при быстром и резком подъеме АД.
|
|
|
В табл. 2.7 (глава 2) были представлены нормальные величины некоторых эхокардиографических показателей глобальной систолической функции ЛЖ. Напомним, что умеренно выраженная систолическая дисфункция ЛЖ сопровождается снижением ФВ до 40–45% и ниже, увеличением КСО и КДО (т.е. наличием умеренной дилатации ЛЖ) и сохранением в течение некоторого времени нормальных значений СИ (2,2–2,7 л/мин/м2). При выраженной систолической дисфункции ЛЖ происходит дальнейшее падение величины ФВ, еще большее увеличение КДО и КСО (выраженная миогенная дилатация ЛЖ) и уменьшение СИ до 2,2 л/мин/м2 и ниже.
Диастолическая функция ЛЖ. Диастолическую функцию ЛЖ оценивают по результатам исследования трансмитрального диастолического кровотока в импульсном допплеровском режиме (подробнее см. главу 2). Определяют: 1) максимальную скорость раннего пика диастолического наполнения (Vmax Peak Е); 2) максимальную скорость трансмитрального кровотока во время систолы левого предсердия (Vmax Peak А); 3) площадь под кривой (интеграл скорости) раннего диастолического наполнения (MV VTI Peak Е) и 4) площадь под кривой позднего диастолического наполнения (MV VTI Peak А); 5) отношение максимальных скоростей (или интегралов скорости) раннего и позднего наполнения (Е/А); 6) время изоволюмического расслабления ЛЖ — IVRT (измеряется при одновременной регистрации аортального и трансмитрального кровотока в постоянно-волновом режиме из апикального доступа); 7) время замедления раннего диастолического наполнения (DT).
Наиболее частыми причинами диастолической дисфункции ЛЖ у больных ИБС со стабильной стенокардией являются:
- атеросклеротический (диффузный) и постинфарктный кардиосклероз;
- хроническая ишемия миокарда, в том числе “гибернирующий” или “оглушенный” миокард ЛЖ;
- компенсаторная гипертрофия миокарда, особенно выраженная у больных с сопутствующей АГ.
В большинстве случаев наблюдаются признаки диастолической дисфункции ЛЖ по типу “замедленной релаксации”, для которой характерно снижение скорости раннего диастолического наполнения желудочка и перераспределение диастолического наполнения в пользу предсердного компонента. При этом значительная часть диастолического кровотока осуществляется во время активной систолы ЛП. На допплерограммах трансмитрального кровотока выявляется снижение амплитуды пика Е и увеличение высоты пика А (рис. 2.57). Отношение Е/А уменьшается до 1,0 и ниже. Одновременно определяется увеличение времени изоволюмического расслабления ЛЖ (IVRT) до 90–100 мс и более и времени замедления раннего диастолического наполнения (DТ) — до 220 мс и более.
|
|
|
Более выраженные изменения диастолической функции ЛЖ (“рестриктивный” тип) характеризуются значительным ускорением раннего диастолического наполнения желудочка (Peak Е) при одновременном уменьшении скорости кровотока во время систолы предсердия (Peak А). В результате отношение Е/А увеличивается до 1,6–1,8 и более. Эти изменения сопровождаются укорочением фазы изоволюмического расслабления (IVRT) до значений меньше 80 мс и времени замедления раннего диастолического наполнения (DT) — меньше 150 мс. Напомним, что “рестриктивный” тип диастолической дисфункции, как правило, наблюдается при застойной СН или непосредственно предшествует ей, свидетельствуя о повышении давления наполнения и КДД ЛЖ.
Оценка нарушений региональной сократимости левого желудочка
Выявление локальных нарушений сократимости ЛЖ с помощью двухмерной эхокардиографии имеет важное значение для диагностики ИБС. Исследование обычно проводится из верхушечного доступа по длинной оси в проекции двух- и четырехкамерного сердца, а также из левого парастернального доступа по длинной и короткой оси.
В соответствии с рекомендациями Американской ассоциации эхокардиографии ЛЖ при этом условно делится на 16 сегментов, располагающихся в плоскости трех поперечных сечений сердца, зарегистрированных из левого парастернального доступа по короткой оси (рис. 5.33). Изображение 6-ти базальных сегментов — переднего (А), переднеперегородочного (AS), заднеперегородочного (IS), заднего (I), заднебокового (IL) и переднебокового (AL) — получают при локации на уровне створок митрального клапана (SAX MV), а средних частей тех же 6-ти сегментов — на уровне папиллярных мышц (SAX PL). Изображения 4-х верхушечных сегментов — переднего (А), перегородочного (S), заднего (I) и бокового (L), — получают при локации из парастернального доступа на уровне верхушки сердца (SAX AP).
|
|
|

|
| Рис. 5.33. Деление миокарда левого желудочка на сегменты (парастернальный доступ по короткой оси). Показаны 16 сегментов, располагающихся в плоскости трех поперечных сечений ЛЖ на уровне створок митрального клапана (SАХ МV), папиллярных мышц (SАХ РL) и верхушки (SАХ АР). BASE — базальные сегменты, МID — средние сегменты, АРЕХ — верхушечные сегменты; А — передний, АS — передне- перегородочный, IS — заднеперегородочный, I — задний, IL — заднебоковой, AL — переднебоковой, L– боковой и S —перегородочный сегменты |
Общее представление о локальной сократимости этих сегментов хорошо дополняют три продольных “среза” ЛЖ, зарегистрированных из парастернального доступа по длинной оси сердца (рис. 5.34), а также в верхушечной позиции четырехкамерного и двухкамерного сердца (рис. 5.35).
| Рис. 5.34. Деление миокарда левого желудочка на сегменты(парастернальный доступ по длинной оси). Обозначения те же | 
|

|
| Рис. 5.35. Деление миокарда левого желудочка на сегменты (апикальный доступ в позиции четырехкамерного и двухкамерного сердца). Обозначения те же |
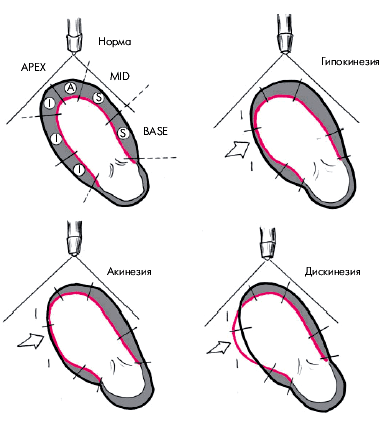
В каждом из этих сегментов оценивается характер и амплитуда движения миокарда, а также степень его систолического утолщения. Различают 3 вида локальных нарушений сократительной функции ЛЖ, объединяемых понятем “асинергия” (рис. 5.36):
1. Акинезия — отсутствие сокращения ограниченной области сердечной мышцы.
2. Гипокинезия — выраженное локальное уменьшение степени сокращения.
3. Дискинезия — парадоксальное расширение (выбухание) ограниченного участка сердечной мышцы во время систолы.
|
| Рис. 5.36. Различные виды локальной асинергии левого желудочка (схема). Черным цветом обозначен контур желудочка во время диастолы, красным — во время систолы |
Причинами локальных нарушений сократимости миокарда ЛЖ у больных ИБС являются:
- острый инфаркт миокарда (ИМ);
- постинфарктный кардиосклероз;
- преходящая болевая и безболевая ишемия миокарда, в том числе ишемия, индуцированная функциональными нагрузочными тестами;
- постоянно действующая ишемия миокарда, еще сохранившего свою жизнеспособность (“гибернирующий миокард”).
Следует также помнить, что локальные нарушения сократимости ЛЖ могут быть обнаружены не только при ИБС. Причинами таких нарушений могут быть:
- дилатационная и гипертрофическая кардиомиопатии, которые нередко также сопровождаются неравномерным поражением миокарда ЛЖ;
- локальные нарушения внутрижелудочковой проводимости (блокады ножек и ветвей пучка Гиса, синдром WPW и др.) любого генеза;
- заболевания, характеризующиеся объемной перегрузкой ПЖ (за счет парадоксальных движений МЖП).
Наиболее выраженные нарушения локальной сократимости миокарда выявляют при остром ИМ и аневризме ЛЖ. Примеры этих нарушений приведены в главе 6. У больных со стабильной стенокардией напряжения, перенесших в прошлом ИМ, можно выявить эхокардиографические признаки крупноочагового или (реже) мелкоочагового постинфарктного кардиосклероза.
|
|
|
Так, при крупноочаговом и трансмуральном постинфарктном кардиосклерозе двухмерная и даже одномерная ЭхоКГ, как правило, позволяет выявить локальные зоны гипокинезии или акинезии (рис. 5.37, а, б). Мелкоочаговый кардиосклероз или преходящая ишемия миокарда характеризуются появлением зон гипокинезии ЛЖ, которые чаще выявляются при переднеперегородочной локализации ишемического повреждения и реже — при его задней локализации. Нередко признаки мелкоочагового (интрамурального) постинфарктного кардиосклероза при эхокардиографическом исследовании не обнаруживаются.

|
| Рис. 5.37. Эхокардиограммы больных с постинфарктным кардиосклерозом и нарушением региональной функции левого желудочка: а — акинезия МЖП и признаки дилатации ЛЖ (одномерная ЭхоКГ); б — акинезия заднего (нижнего) сегмента ЛЖ (одномерная ЭхоКГ) |
 Запомните
При достаточно хорошей визуализации сердца нормальная локальная сократимость ЛЖ у больных ИБС в большинстве случаев позволяет исключить диагноз трансмурального, или крупноочагового постинфарктного рубца и аневризмы ЛЖ, но не является основанием для исключения мелкоочагового (интрамурального) кардиосклероза. Запомните
При достаточно хорошей визуализации сердца нормальная локальная сократимость ЛЖ у больных ИБС в большинстве случаев позволяет исключить диагноз трансмурального, или крупноочагового постинфарктного рубца и аневризмы ЛЖ, но не является основанием для исключения мелкоочагового (интрамурального) кардиосклероза.
|
Нарушения локальной сократимости отдельных сегментов ЛЖ у больных ИБС принято описывать по пятибалльной шкале:
1 балл — нормальная сократимость;
2 балла — умеренная гипокинезия (незначительное снижение амплитуды систолического движения и утолщения в исследуемой области);
3 балла — выраженная гипокинезия;
4 балла — акинезия (отсутствие движения и утолщения миокарда);
5 баллов — дискинезия (систолическое движение миокарда исследуемого сегмента происходит в направлении, противоположном нормальному).
Для такой оценки, помимо традиционного визуального контроля, используется покадровый просмотр изображений, записанных на видеомагнитофоне.
Важное прогностическое значение имеет расчет так называемого индекса локальной сократимости (ИЛС), который представляет собой сумму балльной оценки сократимости каждого сегмента (SS), деленную на общее число исследованных сегментов ЛЖ (n):
ИЛС = ΣS / n.
Высокие значения этого показателя у больных ИМ или постинфарктным кардиосклерозом нередко ассоциируются с повышенным риском летального исхода.
Следует помнить, что при эхокардиографическом исследовании далеко не всегда удается добиться достаточно хорошей визуализации всех 16 сегментов. В этих случаях учитывают только те участки миокарда ЛЖ, которые хорошо выявляются при двухмерной эхокардиографии. Нередко в клинической практике ограничиваются оценкой локальной сократимости 6 сегментов ЛЖ: 1) межжелудочковой перегородки (верхней и нижней ее части); 2) верхушки; 3) переднебазального сегмента; 4) бокового сегмента; 5) заднедиафрагмального (нижнего) сегмента; 6) заднебазального сегмента.
Стресс-эхокардиография. При хронических формах ИБС исследование локальной сократимости миокарда ЛЖ в покое далеко не всегда бывает информативным. Возможности ультразвукового метода исследования существенно расширяются при использовании метода стресс-эхокардиографии — регистрации нарушений локальной сократимости миокарда с помощью двухмерной эхокардиографии во время нагрузки.
Чаще используют динамическую физическую нагрузку (тредмил или велоэргометрия в сидячем или лежачем положении), пробы с дипиридамолом, добутамином или чреспищеводную электростимуляцию сердца (ЧПЭС). Способы проведения нагрузочных тестов и критерии прекращения пробы не отличаются от таковых, используемых при классической электрокардиографии. Двухмерные эхокардиограммы регистрируют в горизонтальном положении пациента до начала исследования и сразу после окончания нагрузки (в течение 60–90 с).
Для выявления нарушений локальной сократимости миокарда используют специальные компьютерные программы, позволяющие оценить степень изменения движения миокарда и его утолщения во время нагрузки (“стресса”) в 16 (или другом количестве) предварительно визуализированных сегментов ЛЖ. Результаты исследования практически не зависят от вида нагрузки, хотя более удобной является ЧПЭС и дипиридамоловая или добутаминовая пробы, поскольку все исследования проводятся в горизонтальном положении пациента.
Чувствительность и специфичность стресс-эхокардиографии в диагностике ИБС достигает 80–90%. Главный недостаток этого метода состоит в том, что результаты исследования существенно зависят от квалификации специалиста, вручную устанавливающего границы эндокарда, которые в дальнейшем и используются для автоматического вычисления локальной сократимости отдельных сегментов.
Исследование жизнеспособности миокарда. Эхокардиография, наряду со сцинтиграфией миокарда с 201Т1 и позитронной эмиссионной томографией, широко используется в последнее время для диагности жизнеспособности “гибернирующего” или “оглушенного” миокарда. С этой целью используют обычно добутаминовый тест. Поскольку даже малые дозы добутамина обладают выраженным положительным инотропным действием, сократимость жизнеспособного миокарда, как правило, возрастает, что сопровождается временным уменьшением или исчезновением эхокардиографических признаков локальной гипокинезии. Эти данные являются основанием для диагностики “гибернирующего” или “оглушенного” миокарда, что имеет важное прогностическое значение, в частности, для определения показаний к хирургическому лечению больных ИБС. Следует, правда, иметь в виду, что при более высоких дозах добутамина усугубляются признаки ишемии миокарда и сократимость вновь падает. Таким образом, при проведении добутаминового теста можно встретиться с двухфазной реакцией сократительного миокарда на введение положительного инотропного агента.
Коронароангиография
Коронароангиография (КАГ) — это метод рентгенологического исследования коронарных артерий сердца (КА) с помощью селективного заполнения венечных сосудов контрастным веществом. Являясь “золотым стандартом” в диагностике ИБС, коронароангиография позволяет определить характер, локализацию и степень атеросклеротического сужения КА, протяженность патологического процесса, состояние коллатерального кровообращения, а также выявить некоторые врожденные пороки развития венечных сосудов, например, аномальное отхождение КА или коронарный артериовенозный свищ. Кроме того, при выполнении КАГ, как правило, производят левую вентрикулографию, что дает возможность оценить ряд важных гемодинамических параметров (см. выше). Полученные при КАГ данные очень важны при выборе метода хирургической коррекции обструктивных поражений КА.
Показания и противопоказания
Показания. В соответствии с рекомендациямиЕвропейского общества кардиологов (1997) наиболее общими показаниями для проведения плановой КАГ являются уточнение характера, степени и локализации поражения КА и оценка нарушений сократительной способности ЛЖ (по данным левой вентрикулографии) у больных ИБС, подлежащих хирургическому лечению, в том числе:
- больные с хроническими формами ИБС (стабильная стенокардия напряжения III–IV ФК) при неэффективности консервативной антиангинальной терапии;
- больные стабильной стенокардией напряжения I–II ФК, перенесшие ИМ;
- больные с постинфарктной аневризмой и прогрессирующей, преимущественно левожелудочковой, сердечной недостаточностью;
- больные стабильной стенокардией напряжения с блокадой ножек пучка Гиса в сочетании с признаками ишемии миокарда по данным сцинтиграфии миокарда;
- больные ИБС в сочетании с аортальными пороками сердца, требующими хирургической коррекции;
- больные с облитерирующим атеросклерозом артерий нижних конечностей, направляемые на хирургическое лечение;
- больные ИБС с тяжелыми нарушениями ритма сердца, требующими уточнения генеза и хирургической коррекции.
В ряде случаев плановая КАГ показана также для верификации диагноза ИБС у больных с болями в области сердца и некоторыми другими симптомами, генез которых не удалось установить с помощью неинвазивных методов исследования, включая ЭКГ12, функциональные нагрузочные пробы, суточное мониторирование ЭКГ по Холтеру и т.п. Однако в этих случаях врач, направляющий такого пациента в специализированное учреждение для проведения КАГ, должен быть особенно осторожен и учитывать многие факторы, определяющие целесообразность этого исследования и риск его осложнений.
Показания для проведения экстренной КАГ у больных острым коронарным синдромом представлены в главе 6 настоящего руководства.
Противопоказания. Проведение КАГ противопоказано:
- при наличии лихорадки;
- при тяжелых заболеваниях паренхиматозных органов;
- при выраженной тотальной (лево- и правожелудочковой) сердечной недостаточности;
- при острых нарушениях мозгового кровообращения;
- при тяжелых нарушениях желудочкового ритма.
Методика исследования
В настоящее время используют главным образом две методики КАГ. Наиболее часто применяется методика Джадкинса, при которой специальный катетер вводят путем чрескожной пункции в бедренную артерию, а затем ретроградно в аорту (рис. 5.38). В устье правой и левой КА вводят по 5–10 мл рентгеноконтрастного вещества и в нескольких проекциях осуществляют рентгеновскую кино- или видеосъемку, позволяющую получить динамические изображения коронарного русла. В тех случаях, когда у пациента имеется окклюзия обеих бедренных артерий, используют методику Соунса, при которой катетер вводят в обнаженную плечевую артерию.
| Рис. 5.38. Схема ретроградного артериального доступа при катетеризации левых отделов сердца. Катетер введен в бедренную артерию, аорту и левые отделы сердца (ЛЖ и ЛП) | 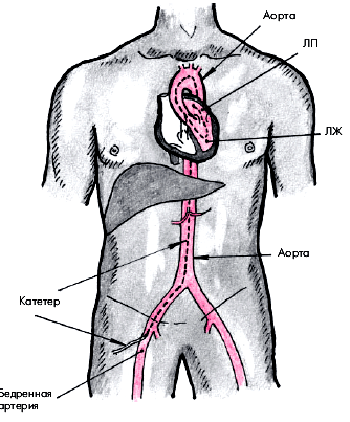
|
К числу наиболее тяжелых осложнений, которые могут возникнуть при проведении КАГ, относятся: 1) нарушения ритма, в том числе желудочковая тахикардия и фибрилляция желудочков; 2) развитие острого ИМ; 3) внезапная смерть.
Интерпретация результатов
При анализе коронарограмм оценивают несколько признаков, достаточно полно характеризующих изменения коронарного русла при ИБС (Ю.С. Петросян и Л.С. Зингерман).
1. Анатомический тип кровоснабжения сердца: правый, левый, сбалансированный (равномерный).
2. Локализация поражений: а) ствол ЛКА; б) ПМЖВ ЛКА; в) ОВ ЛКА; г) передняя диагональная ветвь ЛКА; д) ПКА; е) краевая ветвь ПКА и другие ветви КА.
3. Распространенность поражения: а) локализованная форма (в проксимальной, средней или дистальной трети КА); б) диффузное поражение.
4. Степень сужения просвета:
а. I степень — на 50%;
б. II степень — от 50 до 75%;
в. III степень — более 75%;
г. IV степень — окклюзия КА.
Левый анатомический тип характеризуется преобладанием кровоснабжения за счет ЛКА. Последняя участвует в васкуляризации всего ЛП и ЛЖ, всей МЖП, задней стенки ПП, большей части задней стенки ПЖ и части передней стенки ПЖ, прилежащей к МЖП. ПКА кровоснабжает при этом типе только часть передней стенки ПЖ, а также переднюю и боковую стенки ПП.
При правом типе большая часть сердца (все ПП, большая часть передней и вся задняя стенка ПЖ, задние 2/3 МЖП, задняя стенка ЛЖ и ЛП, верхушка сердца) кровоснабжается за счет ПКА и ее ветвей. ЛКА при этом типе кровоснабжает переднюю и боковую стенки ЛЖ, переднюю треть МЖП, переднюю и боковую стенки ЛП.
Чаще (примерно в 80–85% случаев) встречаются различные варианты сбалансированного (равномерного) типа кровоснабжения сердца, при котором ЛКА кровоснабжает все ЛП, переднюю, боковую и большую часть задней стенки ЛЖ, передние 2/3 МЖП и небольшую часть передней стенки ПЖ, прилегающую к МЖП. ПКА участвует в васкуляризации всего ПП, большей части передней и всей задней стенки ПЖ, задней трети МЖП и небольшой части задней стенки ЛЖ.
Во время проведения селективной КАГ контрастное вещество последовательно вводится в ПКА (рис. 5.39) и в ЛКА (рис. 5.40), что позволяет получить картину коронарного кровоснабжения раздельно для бассейнов ПКА и ЛКА. У больных ИБС по данным КАГ наиболее часто выявляется атеросклеротическое сужение 2–3-х КА — ПМЖВ, ОВ и ПКА. Поражение этих сосудов имеет очень важное диагностическое и прогностическое значение, поскольку сопровождается возникновением ишемических повреждений значительных участков миокарда (рис. 5.41).

|
| Рис. 5.39. Селективная коронароангиограмма (КАГ) правой коронарной артерии и схематическое изображение техники зондирования артерии |

|
| Рис. 5.40. Селективная коронароангиограмма (КАГ) левой коронарной артерии и схематическое изображение техники зондирования артерии |
| Рис. 5.41. Коронароангиограмма, зарегистрированная у больного с критическим стенозом правой коронарной артерии (показан стрелкой) | 
|
 Запомните
Наиболее тяжелое течение заболевания и наихудший прогноз отмечаются при поражении ствола ЛКА. Имеется также четкая зависимость тяжести течения ИБС и числа пораженных КА: наихудший прогноз наблюдается при гемодинамически значимом сужении трех основных КА (ПМЖВ, ОВ и ПКА). Запомните
Наиболее тяжелое течение заболевания и наихудший прогноз отмечаются при поражении ствола ЛКА. Имеется также четкая зависимость тяжести течения ИБС и числа пораженных КА: наихудший прогноз наблюдается при гемодинамически значимом сужении трех основных КА (ПМЖВ, ОВ и ПКА).
|
Степень сужения КА также имеет важное прогностическое значение. Гемодинамически значимым считают сужение просвета венечных артерий на 70% и больше. Стеноз КА до 50% расценивается как гемодинамически незначимый. Однако следует иметь в виду, что конкретные клинические проявления ИБС зависят не только от степени сужения КА, но и от многих других факторов, например, от степени развития коллатерального кровотока, состояния системы гемостаза, вегетативной регуляции сосудистого тонуса, склонности к спазму венечных артерий и др. Иными словами, даже при относительно малом сужении КА или при его отсутствии (по данным КАГ) при определенных обстоятельствах может развиться обширный острый ИМ. С другой стороны, нередки случаи, когда при хорошо развитой сети коллатеральных сосудов даже полная окклюзия одной КА длительное время может не сопровождаться возникновением ИМ.
Оценка характера коллатерального кровообращения имеет, таким образом, важное диагностическое значение. Обычно при значительном и распространенном поражении КА и длительном течении ИБС при КАГ выявляется хорошо развитая сеть коллатералей (см. рис. 5.39), тогда как у больных с “коротким” ишемическим анамнезом и стенозом одной КА коллатеральное кровообращение выражено хуже. Последнее обстоятельство имеет особое значение в случаях внезапного тромбоза, сопровождающегося, как правило, возникновением распространенного и трансмурального некроза сердечной мышцы (например, у сравнительно молодых больных ИБС).
 Запомните
К числу признаков нарушения коронарного кровообращения, выявляемых у больных ИБС при КАГ и имеющих особенно неблагоприятное прогностическое значение, относятся: 1. Поражение ствола ЛКА. 2. Трехсосудистое поражение КА (ПМЖВ, ОВ и ПКА). 3. Сужение просвета венечных артерий на 70% и больше (особенно окклюзия КА). 4. Слабое развитие коллатерального кровообращения. Запомните
К числу признаков нарушения коронарного кровообращения, выявляемых у больных ИБС при КАГ и имеющих особенно неблагоприятное прогностическое значение, относятся: 1. Поражение ствола ЛКА. 2. Трехсосудистое поражение КА (ПМЖВ, ОВ и ПКА). 3. Сужение просвета венечных артерий на 70% и больше (особенно окклюзия КА). 4. Слабое развитие коллатерального кровообращения.
|
Левая вентрикулография
Селективная ангиокардиография ЛЖ(левая вентрикулография) является частью протокола инвазивного исследования больных ИБС, направляемых на операцию реваскуляризации миокарда. Она дополняет результаты КАГ и позволяет провести количественную оценку органических и функциональных нарушений ЛЖ. С помощью левой вентрикулографии можно:
- обнаружить региональные нарушения функции ЛЖ в виде локальных ограниченных участков акинезии, гипокинезии и дискинезии;
- диагностировать аневризму ЛЖ и оценить ее локализацию и размеры;
- выявить внутриполостные образования (пристеночные тромбы и опухоли);
- объективно оценить систолическую функцию ЛЖ на основании инвазивного определения важнейших гемодинамических показателей (ФВ, КСО, КДО, УО, МО, СИ, УИ, среднюю скорость кругового укорочения волокон и т.д.);
- оценить состояние клапанного аппарата сердца, в том числе врожденные и приобретенные патологические изменения аортального и митрального клапанов, которые могут повлиять на результаты хирургической реваскуляризации миокарда.
Локальные нарушения сократимости ЛЖ являются важным признаком очагового поражения миокарда, наиболее характерного для ИБС. Для выявления асинергий ЛЖ вентрикулограммы регистрируют во время систолы и диастолы, количественно оценивая амплитуду и характер движения стенки различных сегментов ЛЖ. На рис. 5.42 показан пример локального нарушения сократимости желудочка у больного ИБС. Наиболее частыми причинами “ асинергий ” ЛЖ у больных стабильной стенокардией напряжения являются рубцовые изменения сердечной мышцы после перенесенного ИМ, а также выраженная ишемия миокарда, в том числе “гибернирующий” и “оглушенный” миокард.

|
| Рис. 5.42. Схематическое изображение левой вентрикулограммы, зарегистрированной у больного ИБС. Красным цветом показан контур полости левого желудочка во время диастолы, пунктиром — во время систолы. Определяется гипокинезия нижнего сегмента. I–II — переднебоковой сегмент, III — верхушечный, IV–V нижний, VI–VII — переднесептальный, VIII — нижний, IХ–Х — задний сегменты левого желудочка |
Для расчета гемодинамических показателей проводят количественную обработку изображений полости левого желудочка, зарегистрированных в одной из проекций в конце систолы и диастолы. Методика расчета подробно описана в главе 6.
| 5.4.4. Лечение |

|
Лечение больных со стабильной стенокардией напряжения должно быть направлено на:
1. Устранение или уменьшение симптомов заболевания, в первую очередь, приступов стенокардии.
2. Повышение толерантности к физической нагрузке.
3. Улучшение прогноза заболевания и предупреждение возникновения нестабильной стенокардии, ИМ и внезапной смерти.
Для достижения этих целей применяется комплекс лечебно-профилактических мероприятий, включающий немедикаментозное, медикаментозное и, при необходимости, хирургическое лечение и предусматривающий активное воздействие на основные звенья патогенеза ИБС:
- антитромбоцитарная терапия (профилактика агрегации тромбоцитов и пристеночного тромбообразования);
- антиангинальные (антиишемические) ЛС (нитраты и молсидомин, b-адреноблокаторы, блокаторы медленных кальциевых каналов и др.);
- применение цитопротекторов;
- лечение и профилактика прогрессирования дисфункции ЛЖ;
- медикаментозная и немедикаментозная коррекция основных ФР ИБС (ГЛП, АГ, курения, ожирения, нарушений углеводного обмена и др.);
- при необходимости — лечение и профилактика нарушений ритма и проводимости;
- радикальное хирургическое устранение обструкции КА (реваскуляризация миокарда).
В настоящее время доказано положительное влияние большинства из перечисленных направлений и способов лечения на прогноз ИБС и частоту возникновения нестабильной стенокардии, ИМ и внезапной смерти.
Антитромбоцитарная терапия
Антитромбоцитарная терапия проводится с целью профилактики “обострений” ИБС, а также возникновения нестабильной стенокардии и ИМ. Она направлена на предотвращение пристеночного тромбообразования и, в известной степени, на сохранение целостности фиброзной оболочки атеросклеротической бляшки.
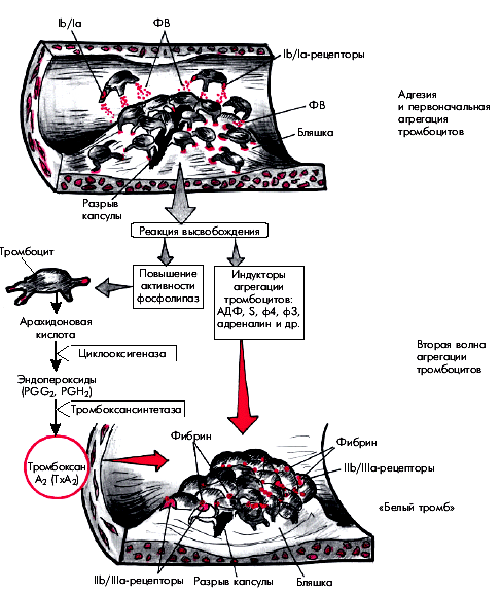
Выше неоднократно упоминалось о том, что в основе “обострений” ИБС и возникновения нестабильной стенокардии (НС) или ИМ лежит разрыв атеросклеротической бляшки в КА с формированием на ее поверхности вначале тромбоцитарного (“белого”), а затем фибринного (“красного”) пристеночного тромба. Начальный этап этого процесса, связанный с адгезией и агрегацией тромбоцитов, подробно описан в разделе 5.2. Упрощенная схема этого процесса, протекающего на поверхности атеросклеротической бляшки, представлена на рис. 5.43.
|
| Рис. 5.43. Упрощенная схема образования тромбоцитарного сгустка в области «осложненной» атеросклеротической бляшки. Фактор Виллебранда. Объяснение в тексте |
Напомним, что в результате разрыва атеросклеротической бляшки обнажаются субэндотелиальные тканевые структуры и липидное ядро бляшек, содержимое которого попадает на поверхность разрыва и в просвет сосуда. Обнажившиеся компоненты соединительнотканного матрикса (коллаген, фактор Виллебранда, фибронектин, лиминин, витронектин и др.), а также детрит липидного ядра, содержащий тканевой тромбопластин, активируют тромбоциты. Последние с помощью гликопротеидных рецепторов (Iа, Ib), расположенных на поверхности тромбоцитов, и фактора Виллебранда прилипают (адгезируют) к поверхности поврежденной бляшки, образуя здесь монослой тромбоцитов, рыхло связанных с поврежденным эндотелием.
Активированные и изменившие свою форму тромбоциты высвобождают индукторы последующей взрывной самоускоряющейся агрегации: АДФ, серотонин, фактор 3 и фактор 4 тромбоцитов, тромбоксан, адреналин и др. (“реакция высвобождения”). Одновременно активируется метаболизм арахидоновой кислоты и при участии ферментов циклооксигеназы и тромбоксансинтетазы образуется тромбоксан А2, который также обладает мощным агрегирующим, а также вазоконстрикторным действием.
В результате возникает вторая волна агрегации тромбоцитов и образуется тромбоцитарный агрегат (“белый” тромб). Следует помнить, что в процессе этой стадии агрегации тромбоциты плотно связываются друг с другом с помощью молекул фибриногена, которые, взаимодействуя с рецепторами IIb/IIIа тромбоцитов, плотно “сшивают” кровяные пластинки между собой. Одновременно с помощью фактора Виллебранда тромбоциты прикрепляются к подлежащему субэндотелию.
В дальнейшем активируется система коагуляции гемостаза и образуется фибринный тромб (см. главу 6).
Таким образом, адгезия и агрегация тромбоцитов — это первый начальный этап тромбообразования, важнейшими звеньями которого являются:
- функционирование специфических рецепторов тромбоцитов (Iа, Ib, IIb/IIIа и др.), обеспечивающих адгезию и окончательную агрегацию кровяных пластинок, и
- активация метаболизма арахидоновой кислоты.
Как известно, арахидоновая кислота входит в состав клеточных мембран тромбоцитов и сосудистого эндотелия. Под действием фермента циклооксигеназы она переходит в эндопероксиды. В дальнейшем в тромбоцитах под действием тромбоксансинтетазы эндопероксиды превращаются в тромбоксан А2, являющийся мощным индуктором дальнейшей агрегации тромбоцитов и одновременно обладающий вазоконстрикторным действием (рис. 5.44).

|
| Рис. 5.44. Схема метаболизма арахидоновой кислоты и механизм действия аспирина (А) и курантила (К). Красными стрелками оьозначено ингибирование антиагрегантами соответствующих превращений |
В сосудистом эндотелии пероксиды превращаются в простациклин, отличающийся противоположными эффектами: он ингибирует агрегацию тромбоцитов и обладает дилатирующими свойствами.
Действие тромбоксана А2 (ТхА2) и простациклина на агрегацию тромбоцитов реализуется благодаря их различному влиянию на аденилатциклазу, под действием которой АТФ превращается в цАМФ: тромбоксан А2 ингибирует это превращение, а простациклин — активирует. Следует помнить, что высокие концентрации цАМФ угнет
|
|
|


