 |
Описание химической связи в методе молекулярных орбиталей (МО)
|
|
|
|
Метод ВС широко используется химиками. В рамках этого метода большая и сложная молекула рассматривается как состоящая из отдельных двухцентровых и двухэлектронных связей. Принимается, что электроны, обусловливающие химическую связь, локализованы (расположены) между двумя атомами. К большинству молекул метод ВС может быть применен с успехом. Однако имеется ряд молекул, к которым этот метод неприменим или его выводы находятся в противоречии с опытом.
Установлено, что в ряде случаев определяющую роль в образовании химической связи играют не электронные пары, а отдельные электроны. На возможность химической связи при помощи одного электрона указывает существование иона  . При образовании этого иона из атома водорода и иона водорода выделяется энергия в 255 кДж (61 ккал). Таким образом, химическая связь в ионе
. При образовании этого иона из атома водорода и иона водорода выделяется энергия в 255 кДж (61 ккал). Таким образом, химическая связь в ионе  довольно прочная.
довольно прочная.
Если попробовать описать химическую связь в молекуле кислорода по методу ВС, то придем к заключению, что, во-первых, она должна быть двойной (σ- и p-связи), во-вторых, в молекуле кислорода все электроны должны быть спарены, т.е. молекула О2 должна быть диамагнитна. [У диамагнитных веществ атомы не обладают постоянным магнитным моментом и вещество выталкивается из магнитного поля. Парамагнитным веществом называется то, атомы которого или молекулы обладают магнитным моментом, и оно обладает свойством втягиваться в магнитное поле]. Экспериментальные данные показывают, что по энергии связь в молекуле кислорода действительно двойная, но молекула является не диамагнитной, а парамагнитной. В ней имеется два неспаренных электрона. Метод ВС бессилен объяснить это факт.
Наилучшим способом квантовомеханической трактовки химической связи в настоящее время считается метод молекулярных орбиталей (МО). Однако он гораздо сложнее метода ВС и не столь нагляден, как последний.
|
|
|
Метод МО рассматривает все электроны молекулы находящимися на молекулярных орбиталях. В молекуле электрон находится на определенной МО, описываемой соответствующей волновой функцией ψ.
Типы МО. Когда электрон одного атома при сближении попадает в сферу действия другого атома, характер движения, а следовательно, и волновая функция электрона, изменяется. В образовавшейся молекуле волновые функции, или орбитали электронов, неизвестны. Существует несколько способов определения вида МО по известным АО. Чаще всего МО получают линейной комбинацией атомных орбиталей (ЛКАО). Принцип Паули, правило Гунда, принцип наименьшей энергии справедлив и для метода МО.


Рис. 2.2 Образование связывающих и разрыхляющих молекулярных орбиталей из атомных орбиталей.
В простейшем графическом виде МО, как ЛКАО, можно получить, складывая или вычитая волновые функции. На рисунке 2.2 представлено образование связывающих и разрыхляющих МО из исходных АО.
АО могут образовывать МО, если энергии соответствующих АО близки по величине и АО имеют одинаковую симметрию относительно оси связи.
Волновые функции, или орбитали, водорода 1s могут дать две линейные комбинации – одну при сложении, другую - при вычитании (рис. 2.2).
Когда волновые функции складываются, то в области перекрывания плотность электронного облака, пропорциональная ψ2, становится больше, между ядрами атомов создается избыточный отрицательный заряд и ядра атомов притягиваются к нему. МО, полученная сложением волновых функций атомов водорода, называется связывающей.
Если волновые функции вычитаются, то в области между ядрами атомов плотность электронного облака становится равной нулю, электронное облако «выталкивается» из области, находящейся между атомами. Образующаяся МО не может связывать атомы и называется разрыхляющей.
|
|
|
Поскольку s-орбитали водорода образуют только σ-связь, то полученные МО обозначаются σcв и σр. МО, образованные 1s-атомными орбиталями, обозначаются σcв1s и σр1s.
На связывающей МО потенциальная (и полная) энергия электронов оказывается меньше, чем на АО, а на разрыхляющей – больше. По абсолютной величине возрастание энергии электронов на разрыхляющих орбиталях несколько больше уменьшения энергии на связывающих орбиталях. Электрон, находящийся на связывающих орбиталях, обеспечивает связь между атомами, стабилизируя молекулу, а электрон на разрыхляющей орбитали дестабилизирует молекулу, т.е. связь между атомами ослабевает. Еразр. > Есв.
МО образуются и из 2р-орбиталей одинаковой симметрии: связывающая и разрыхляющая σ-орбитали из 2р-орбиталей, расположенных по оси х. Они обозначаются σcв2р и σр2р. Связывающая и разрыхляющая p-орбитали образуются из 2рz-орбиталей. Обозначаются они соответственно πсв2рz, πp2pz. Аналогично образуются πсв2ру и πр2ру-орбитали.
Заполнение МО. Заполнение МО электронами происходит в порядке увеличения энергии орбиталей. В случае, если МО имеют одинаковую энергию (πсв- или πр-орбитали), то заполнение происходит по правилу Хунда так, чтобы спиновый момент молекулы был наибольшим. Каждая МО, как и атомная, может вместить два электрона. Как отмечалось, магнитные свойства атомов или молекул зависят от наличия неспаренных электронов: если в молекуле есть неспаренные электроны, то она парамагнитна, если нет – диамагнитна.
Рассмотрим ион  .
.
Из схемы видно, что единственный электрон размещается по σcв - МО. Образуется устойчивое соединение с энергией связи 255 кДж/моль, длиной связи - 0,106 нм. Молекулярный ион  парамагнитен. Если принять, что кратность связи, как в методе ВС, определяется количеством электронных пар, то кратность связи в
парамагнитен. Если принять, что кратность связи, как в методе ВС, определяется количеством электронных пар, то кратность связи в  равна ½. Записать процесс образования
равна ½. Записать процесс образования  можно следующим образом:
можно следующим образом:
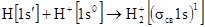 .
.
Эта запись означает, что на σcв МО, образованной из 1s АО, находится один электрон.
Молекула обычного водорода содержит уже два электрона с противоположными спинами на σcв1s-орбитали:  . Энергия связи в Н2 больше, чем в
. Энергия связи в Н2 больше, чем в  - 435 кДж/моль, а длина связи (0,074 нм) – меньше. В молекуле Н2 имеется одинарная связь, молекула диамагнитна.
- 435 кДж/моль, а длина связи (0,074 нм) – меньше. В молекуле Н2 имеется одинарная связь, молекула диамагнитна.
|
|
|

Рис. 2.3. Энергетическая диаграмма АО и МО в системе их двух атомов водорода.
Молекулярный ион  ([He[1s2]+He+[1s1] ® He+2[(sсв1s)2(sр1s)1]) имеет уже один электрон на σразр.1s-орбитали. Энергия связи в
([He[1s2]+He+[1s1] ® He+2[(sсв1s)2(sр1s)1]) имеет уже один электрон на σразр.1s-орбитали. Энергия связи в  - 238 кДж/моль (по сравнению с Н2 понижена), а длина связи (0,108 нам) - увеличена. Кратность связи равна ½ (кратность связи равна половине разности числа электронов на связывающих и разрыхляющих орбиталях).
- 238 кДж/моль (по сравнению с Н2 понижена), а длина связи (0,108 нам) - увеличена. Кратность связи равна ½ (кратность связи равна половине разности числа электронов на связывающих и разрыхляющих орбиталях).
| Li2 | (Be)2 | B2 | N2 | O2 | (Ne)2 | CO | NO | |
| σp2px | – | – | – | – | – | ¯ | – | – |
| πp2py, πp2pz | – – | – – | – – | – – | , | ¯,¯ | – – | ,– |
| σcв2px | – | – | – | ¯ | ¯ | ¯ | ¯ | ¯ |
| πcв2py, πcв2pz | – – | – – | , | ¯,¯ | ¯,¯ | ¯,¯ | ¯,¯ | ¯,¯ |
| σр2s | – | ¯ | ¯ | ¯ | ¯ | ¯ | ¯ | ¯ |
| σcв2s | ¯ | ¯ | ¯ | ¯ | ¯ | ¯ | ¯ | ¯ |
| Кратность связи | 1 | 0 | 1 | 3 | 2 | 0 | 3 | 2 ½ |
| Энергия связи, кДж/моль | 105 | – | 288 | 941 | 566 | – | 1070 | 677 |
Гипотетическая молекула He2 имела бы два электрона на σcв1s-орбитали и два электрона на σр1s-орбитали. Поскольку один электрон на разрыхляющей орбитали уничтожает связывающее действие электрона на связывающей орбитали, то молекула He2 существовать не может. К такому же выводу приводит и метод ВС.
Ниже показан порядок заполнения МО электронами при образовании молекул элементами II периода. В соответствии со схемами молекулы В2 и О2 – парамагнитны, а молекула Ве2 - существовать не может.
Образование молекул из атомов элементов II периода может быть записано следующим образом (К – внутренние электронные слои):

Физические свойства молекул и ММО
Существование связывающих и разрыхляющих МО подтверждается физическими свойствами молекул. Метод МО позволяет предвидеть, что если при образовании молекулы из атомов электроны в молекуле попадают на связывающие орбитали, то потенциалы ионизации молекул должны быть больше, чем потенциалы ионизации атомов, а если электроны попадают на разрыхляющие орбитали, то наоборот.
|
|
|
Так, потенциалы ионизации молекул водорода и азота (связывающие орбитали) – 1485 и 1500 кДж/моль соответственно – больше, чем потенциалы ионизации атомов водорода и азота – 1310 и 1390 кДж/моль, а потенциалы ионизации молекул кислорода и фтора (разрыхляющие орбитали) – 1170 и 1523 кДж/моль – меньше, чем у соответствующих атомов – 1310 и 1670 кДж/моль. При ионизации молекул прочность связи уменьшается, если электрон удаляется со связывающей орбитали (H2 и N2), и увеличивается, если электрон удаляется с разрыхляющей орбитали(О2 и F2).
|
|
|


