 |
Теория сильных электролитов.
|
|
|
|
Эта теория была создана в 1923 г Дебаем и Хюккелем. Поскольку в растворе сильные электролиты практически полностью диссоциируют на ионы, постольку в растворе резко увеличивается концентрация частиц (ионов), Þ расстояние между ними резко снижается и усиливается кулоновское взаимодействие между ионами.
Согласно закону Кулона сила притяжения или отталкивания между ионами равна:
F = Z1Z2/(er2),
где Z1 , Z2 – заряды ионов, r – расстояние меж ними, e - диэлектрическая проницаемость.
Кулоновским взаимодействием пренебречь нельзя, что делала теория Аррениуса. Поэтому законы, выведенные для слабых электролитов, оказались не действительны для сильных электролитов. Вследствие этого было введено понятие АКТИВНОСТИ. Активность – это действительная концентрация, которая может быть равна концентрации в разбавленных растворах, а в концентрированных - может изменяться в большую или меньшую сторону. Активность связана с концентрацией уравнением:
 ,
,
где f – коэффициент активности изменяется в зависимости от концентрации.
При f = 1, а = С (в разб. Р-рах)..
Причем оказалось, что коэффициент активности сам весьма сложно зависит от концентрации (рис. 1).

| Рис. Зависимость коэффициента активности электролита от его концентрации |
В области низких концентраций (заштрихованная область) f = 1, а = С. На дальнейшем участке кривой f¹ 1 (концентрированные растворы), а ход кривой зависит от природы электролита, ионов, природы растворителя и др.
| С (NaCl), моль/кг | f+ | f- |
| 0,2 | 0,744 | 0,726 |
| 0,5 | 0,701 | 0,661 |
| 1,0 | 0,617 | 0,620 |
| 2,0 | 0,756 | 0,590 |
| 3,0 | 0,870 | 0,586 |
| 4,0 | 1,036 | 0,591 |
KA«K+ + A-,  , то правильно записать
, то правильно записать  .
.
В этом уравнении принимает участие не концентрация вещества, а его активность.
|
|
|
В 1929 Хюккель показал, что определить активность или коэффициент активности в растворе отдельного иона нельзя, а коэффициент активности можно определить экспериментально в целом. Он равен  из произведения коэффициентов активности катиона и аниона.
из произведения коэффициентов активности катиона и аниона.
 .
.
Существует параметр, позволяющий определить коэффициент активности, который называют ионной силой раствора 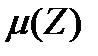 :
:
 ,
,
Сi – молярная концентрация i-того иона, а zi– его заряд.
[m] = моль×л–1×кул2
Физический смысл ионной силы раствора: она характеризует суммарную величину электрического поля, образованного всеми ионами раствора, на произвольно выбранный ион в этом растворе.
Задача:
Вычислить ионную силу раствора, в 1 литре которого находится 0,1 моль Ba(NO3)2 и 0,2 моль KCl.
 ,
,
Ba(NO3)2 «Ba2++  ; KCl«K+ + Cl-
; KCl«K+ + Cl-
 .
.
Если ионная сила находится в пределах 0,6 – 0,8 – это растворы средней концентрации, если менее 0,6 – разбавленные, если более 0,8 – концентрированные.
Ионная сила раствора позволяет определить коэффициент активности. В разбавленных растворах с концентрацией C£ 10-3 моль/л Дебай предложил уравнение:
В общем виде:  , Z – заряд иона, В – коэффициент (из таблицы), при 250С он равен 0,5. При более высоких или низких температурах коэффициент может меняться.
, Z – заряд иона, В – коэффициент (из таблицы), при 250С он равен 0,5. При более высоких или низких температурах коэффициент может меняться.
 Первое приближение Дебая для разб. растворов.
Первое приближение Дебая для разб. растворов.
Для растворов средней силы им предложено второе приближение (концентрация более 10-2 моль/л.:
 Второе приближение Дебая.
Второе приближение Дебая.
Для еще более концентрированных растворов (С£5×10–2 моль/л) Дэвис вывел уравнение:
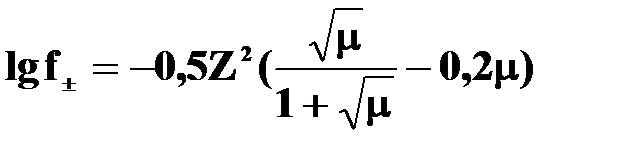 - уравнение Дэвиса.
- уравнение Дэвиса.
Задача. Рассчитать ионную силу и концентрацию ионов в 0,5 М растворе BaCl2.
BaCl2 «Ba+ + 2Cl-
m = ½ (0,5∙22 + 1∙12) = 1,5.
Рассчитать коэффициент активности и активность ионов.
С(Zn(NO3)2 = 0,05 M. Используя первое и второе приближение Дебая, получим:
 и
и  .
.
Zn(NO3)2 «Zn 2+ +  m = ½ (0,05∙22 + 0,1∙12) = 0,15.
m = ½ (0,05∙22 + 0,1∙12) = 0,15.


а (Zn2+) = 0,17∙0,05 = 0,0085.
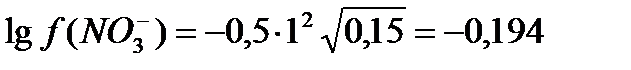 ;
;
 ;
;
 ;
;

 .
.  ;
;
а (Zn2+) = 0,276∙0,05 = 0,014.
|
|
|
 ;
;  ;
;
 .
.
Исходя из методов Дебая, коэффициент активности не зависит от природы ионов, т.к. в этих уравнениях используется заряд ионов и ионная сила, связанная с концентрацией. Таким образом, эти уравнения не учитывают природу ионов.
|
|
|


