 |
Общая теория сплавов. Строение, кристаллизация и свойства сплавов. Диаграмма состояния.
|
|
|
|
1. Понятие о сплавах и методах их получения
2. Основные понятия в теории сплавов.
3. Особенности строения, кристаллизации и свойств сплавов: механических смесей, твердых растворов, химических соединений
4. Классификация сплавов твердых растворов.
5. Кристаллизация сплавов.
6. Диаграмма состояния.
Понятие о сплавах и методах их получения
Под сплавом понимают вещество, полученное сплавлением двух или более элементов. Возможны другие способы приготовления сплавов: спекания, электролиз, возгонка. В этом случае вещества называются псевдосплавами.
Сплав, приготовленный преимущественно из металлических элементов и обладающий металлическими свойствами, называется металлическим сплавом. Сплавы обладают более разнообразным комплексом свойств, которые изменяются в зависимости от состава и метода обработки.
Основные понятия в теории сплавов.
Система – группа тел выделяемых для наблюдения и изучения.
В металловедении системами являются металлы и металлические сплавы. Чистый металл является простой однокомпонентной системой, сплав – сложной системой, состоящей из двух и более компонентов.
Компоненты – вещества, образующие систему. В качестве компонентов выступают чистые вещества и химические соединения, если они не диссоциируют на составные части в исследуемом интервале температур.
Фаза – однородная часть системы, отделенная от других частей системы поверхностного раздела, при переходе через которую структура и свойства резко меняются.
Вариантность (C) (число степеней свободы) – это число внутренних и внешних факторов (температура, давление, концентрация), которые можно изменять без изменения количества фаз в системе.
|
|
|
Если вариантность C = 1 (моновариантная система), то возможно изменение одного из факторов в некоторых пределах, без изменения числа фаз.
Если вариантность C = 0 (нонвариантная cистема), то внешние факторы изменять нельзя без изменения числа фаз в оистеме
Существует математическая связь между числом компонентов (К), числом фаз (Ф) и вариантностью системы (С). Это правило фаз или закон Гиббса

Если принять, что все превращения происходят при постоянном давлении, то число переменных уменьшится

где: С – число степеней свободы, К – число компонентов, Ф – число фаз, 1 – учитывает возможность изменения температуры.
Особенности строения, кристаллизации и свойств сплавов: механических смесей, твердых растворов, химических соединений
Строение металлического сплава зависит от того, в какие взаимодействия вступают компоненты, составляющие сплав. Почти все металлы в жидком состоянии растворяются друг в друге в любых соотношениях. При образовании сплавов в процессе их затвердевании возможно различное взаимодействие компонентов.
В зависимости от характера взаимодействия компонентов различают сплавы:
1. механические смеси;
2. химические соединения;
3. твердые растворы.
Сплавы механические смеси образуются, когда компоненты не способны к взаимному растворению в твердом состоянии и не вступают в химическую реакцию с образованием соединения.
Образуются между элементами значительно различающимися по строению и свойствам, когда сила взаимодействия между однородными атомами больше чем между разнородными. Сплав состоит из кристаллов входящих в него компонентов (рис. 4.1). В сплавах сохраняются кристаллические решетки компонентов.

Рис. 4.1. Схема микроструктуры механической смеси
Сплавы химические соединения образуются между элементами, значительно различающимися по строению и свойствам, если сила взаимодействия между разнородными атомами больше, чем между однородными.
|
|
|
Особенности этих сплавов:
1. Постоянство состава, то есть сплав образуется при определенном соотношении компонентов, химическое соединение обозначается Аn Вm/
2. Образуется специфмческая, отличающаяся от решеток элементов, составляющих химическое соединение, кристаллическая решетка с правильным упорядоченным расположением атомов (рис. 4.2)
3. Ярко выраженные индивидуальные свойства
4. Постоянство температуры кристаллизации, как у чистых компонентов

Рис. 4.2. Кристаллическая решетка химического соединения
Сплавы твердые растворы – это твердые фазы, в которых соотношения между компонентов могут изменяться. Являются кристаллическими веществами.
Характерной особенностью твердых растворов является:наличие в их кристаллической решетке разнородных атомов, при сохранении типа решетки растворителя.
Твердый раствор состоит из однородных зерен (рис. 4.3).

Рис.4.3. Схема микроструктуры твердого раствора
Классификация сплавов твердых растворов.
По степеням растворимости компонентов различают твердые растворы:
· с неограниченной растворимостью компонентов;
· с ограниченной растворимостью компонентов.
При неограниченной растворимости компонентов кристаллическая решетка компонента растворителя по мере увеличения концентрации растворенного компонента плавно переходит в кристаллическую решетку растворенного компонента.
Для образования растворов с неограниченной растворимостью необходимы:
1. изоморфность (однотипность) кристаллических решеток компонентов;
2. близость атомных радиусов компонентов, которые не должны отличаться более чем на 8…13 %.
3. близость физико-химических свойств подобных по строение валентных оболочек атомов.
При ограниченной растворимости компонентов возможна концентрация растворенного вещества до определенного предела, При дальнейшем увеличении концентрации однородный твердый раствор распадается с образованием двухфазной смеси.
По характеру распределения атомов растворенного вещества в кристаллической решетке растворителя различают твердые растворы:
|
|
|
· замещения;
· внедрения;
· вычитания.
В растворах замещения в кристаллической решетке растворителя часть его атомов замещена атомами растворенного элемента (рис. 4.4 а). Замещение осуществляется в случайных местах, поэтому такие растворы называют неупорядоченными твердыми растворами.
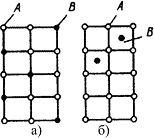
Рис.4.4. Кристаллическая решетка твердых растворов замещения (а), внедрения (б)
При образовании растворов замещения периоды решетки изменяются в зависимости от разности атомных диаметров растворенного элемента и растворителя. Если атом растворенного элемента больше атома растворителя, то элементарные ячейки увеличиваются, если меньше – сокращаются. В первом приближении это изменение пропорционально концентрации растворенного компонента. Изменение параметров решетки при образовании твердых растворов – важный момент, определяющий изменение свойств. Уменьшение параметра ведет к большему упрочнению, чем его увеличение.
Твердые растворы внедрения образуются внедрением атомов растворенного компонента в поры кристаллической решетки растворителя (рис. 4.4 б).
Образование таких растворов, возможно, если атомы растворенного элемента имеют малые размеры. Такими являются элементы, находящиеся в начале периодической системы Менделеева, углерод, водород, азот, бор. Размеры атомов превышают размеры межатомных промежутков в кристаллической решетке металла, это вызывает искажение решетки и в ней возникают напряжения. Концентрация таких растворов не превышает 2-2.5%
Твердые растворы вычитания или растворы с дефектной решеткой. образуются на базе химических соединений, при этом возможна не только замена одних атомов в узлах кристаллической решетки другими, но и образование пустых, не занятых атомами, узлов в решетке.
К химическому соединению добавляют, один из входящих в формулу элементов, его атомы занимают нормальное положение в решетке соединения, а места атомов другого элемента остаются, незанятыми.
Кристаллизация сплавов.
Кристаллизация сплавов подчиняется тем же закономерностям, что и кристаллизация чистых металлов. Необходимым условием является стремление системы в состояние с минимумом свободной энергии.
|
|
|
Основным отличием является большая роль диффузионных процессов, между жидкостью и кристаллизующейся фазой. Эти процессы необходимы для перераспределения разнородных атомов, равномерно распределенных в жидкой фазе.
В сплавах в твердых состояниях, имеют место процессы перекристаллизации, обусловленные аллотропическими превращениями компонентов сплава, распадом твердых растворов, выделением из твердых растворов вторичных фаз, когда растворимость компонентов в твердом состоянии меняется с изменением температуры.
Эти превращения называют фазовыми превращениями в твердом состоянии.
При перекристаллизации в твердом состоянии образуются центры кристаллизации и происходит их рост.
Обычно центры кристаллизации возникают по границам зерен старой фазы, где решетка имеет наиболее дефектное строение, и где имеются примеси, которые могут стать центрами новых кристаллов. У старой и новой фазы, в течение некоторого времени, имеются общие плоскости. Такая связь решеток называется когерентной связью. В случае различия строения старой и новой фаз превращение протекает с образованием промежуточных фаз.
Нарушение когерентности и обособления кристаллов наступает, когда они приобретут определенные размеры.
Процессы кристаллизации сплавов изучаются по диаграммам состояния.
Диаграмма состояния.
Диаграмма состояния представляет собой графическое изображение состояния любого сплава изучаемой системы в зависимости от концентрации и температуры (рис. 4.5)
. 
Рис. 4.5. Диаграмма состояния
Диаграммы состояния показывают устойчивые состояния, т.е. состояния, которые при данных условиях обладают минимумом свободной энергии, и поэтому ее также называют диаграммой равновесия, так как она показывает, какие при данных условиях существуют равновесные фазы.
Построение диаграмм состояния наиболее часто осуществляется при помощи термического анализа.
В результате получают серию кривых охлаждения, на которых при температурах фазовых превращений наблюдаются точки перегиба и температурные остановки.
Температуры, соответствующие фазовым превращениям, называют критическими точками. Некоторые критические точки имеют названия, например, точки отвечающие началу кристаллизации называют точками ликвидус, а концу кристаллизации – точками солидус.
По кривым охлаждения строят диаграмму состава в координатах: по оси абсцисс –концентрация компонентов, по оси ординат – температура.
|
|
|
Шкала концентраций показывает содержание компонента В. Основными линиями являются линии ликвидус (1) и солидус (2), а также линии соответствующие фазовым превращениям в твердом состоянии (3, 4).
По диаграмме состояния можно определить температуры фазовых превращений, изменение фазового состава, приблизительно, свойства сплава, виды обработки, которые можно применять для сплава.
Лекция 5
Диаграммы состояния двухкомпонентных сплавов.
1. Диаграмма состояния сплавов с неограниченной растворимостью компонентов в твердом состоянии (сплавы твердые растворы с неограниченной растворимостью)
2. Диаграмма состояния сплавов с отсутствием растворимости компонентов в компонентов в твердом состоянии (механические смеси)
3. Диаграмма состояния сплавов с ограниченной растворимостью компонентов в твердом состоянии
4. Диаграмма состояния сплавов, компоненты которых образуют химические соединения.
5. Диаграмма состояния сплавов, испытывающих фазовые превращения в твердом состоянии (переменная растворимость)
6. Связь между свойствами сплавов и типом диаграммы состояния
Диаграмма состояния сплавов с неограниченной растворимостью компонентов в твердом состоянии (сплавы твердые растворы с неограниченной растворимостью)
Диаграмма состояния и кривые охлаждения сплавов системы представлены на рис. 5.1.

Рис.5.1 Диаграмма состояния сплавов с неограниченной растворимостью компонентов в твердом состоянии (а); кривые охлаждения типичных сплавов (б)
Сначала получают термические кривые. Полученные точки переносят на диаграмму, соединив точки начала кристаллизации сплавов и точки конца кристаллизации, получают диаграмму состояния.
Проведем анализ полученной диаграммы.
1. Количество компонентов: К = 2 (компоненты А и В).
2. Число фаз: f = 2 (жидкая фаза L, кристаллы твердого раствора  )
)
3. Основные линии диаграммы:
· acb – линия ликвидус, выше этой линии сплавы находятся в жидком состоянии;
· adb – линия солидус, ниже этой линии сплавы находятся в твердом состоянии.
4. Характерные сплавы системы:
Чистые компоненты А и В кристаллизуются при постоянной температуре, кривая охлаждения компонента В представлена на рис. 5.1, б.
Остальные сплавы кристаллизуются аналогично сплаву I, кривая охлаждения которого представлена на рис. 5.1, б.
Процесс кристаллизации сплава I: до точки 1 охлаждается сплав в жидком состоянии. При температуре, соответствующей точке 1, начинают образовываться центры кристаллизации твердого раствора  . На кривой охлаждения отмечается перегиб (критическая точка), связанный с уменьшением скорости охлаждения вследствие выделения скрытой теплоты кристаллизации. На участке 1–2 идет процесс кристаллизации, протекающий при понижающейся температуре, так как согласно правилу фаз в двухкомпонентной системе при наличии двух фаз (жидкой и кристаллов твердого раствора
. На кривой охлаждения отмечается перегиб (критическая точка), связанный с уменьшением скорости охлаждения вследствие выделения скрытой теплоты кристаллизации. На участке 1–2 идет процесс кристаллизации, протекающий при понижающейся температуре, так как согласно правилу фаз в двухкомпонентной системе при наличии двух фаз (жидкой и кристаллов твердого раствора  ) число степеней свободы будет равно единице
) число степеней свободы будет равно единице 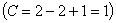 . При достижении температуры соответствующей точке 2, сплав затвердевает, при дальнейшем понижении температуры охлаждается сплав в твердом состоянии, состоящий из однородных кристаллов твердого раствора
. При достижении температуры соответствующей точке 2, сплав затвердевает, при дальнейшем понижении температуры охлаждается сплав в твердом состоянии, состоящий из однородных кристаллов твердого раствора  .
.
Схема микроструктуры сплава представлена на рис. 5.2.

Рис. 5.2. Схема микроструктуры сплава – однородного твердого раствора
5. Количественный структурно-фазовый анализ сплава.
Пользуясь диаграммой состояния можно для любого сплава при любой температуре определить не только число фаз, но и их состав и количественное соотношение. Для этого используется правило отрезков. Для проведения количественного структурно-фазового анализа через заданную точку проводят горизонталь (коноду) до пересечения с ближайшими линиями диаграммы (ликвидус, солидус или оси компонентов).
а). Определение состава фаз в точке m:
Для его определения через точку m проводят горизонталь до пересечения с ближайшими линиями диаграммы: ликвидус и солидус.
Состав жидкой фазы определяется проекцией точки пересечения горизонтали с линией ликвидус p на ось концентрации.
Состав твердой фазы определяется проекцией точки пересечения горизонтали с линией солидус q (или осью компонента) на ось концентрации.
Состав жидкой фазы изменяется по линии ликвидуса, а состав твердой фазы – по линии солидуса.
С понижением температуры состав фаз изменяется в сторону уменьшения содержания компонента В.
б). Определение количественного соотношения жидкой и твердой фазы при заданной температуре (в точке m):
Количественная масса фаз обратно пропорциональна отрезкам проведенной коноды.Рассмотрим проведенную через точку m коноду и ее отрезки.
Количество всего сплава (Qсп) определяется отрезком pq.
О трезок, прилегающий к линии ликвидус pm, определяет количество твердой фазы.
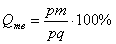
Отрезок, прилегающий к линии солидус (или к оси компонента) mq, определяет количество жидкой фазы.

Диаграмма состояния сплавов с отсутствием растворимости компонентов в компонентов в твердом состоянии (механические смеси)
Диаграмма состояния и кривые охлаждения типичных сплавов системы представлены на рис. 5.3.

Рис. 5.3. Диаграмма состояния сплавов с отсутствием растворимости компонентов в твердом состоянии (а) и кривые охлаждения сплавов (б)
Проведем анализ диаграммы состояния.
1. Количество компонентов: К = 2 (компоненты А и В);
2. Число фаз: f = 3 (кристаллы компонента А, кристаллы компонента В, жидкая фаза).
3. Основные линии диаграммы:
· линия ликвидус acb, состоит из двух ветвей, сходящихся в одной точке;
· линия солидус ecf, параллельна оси концентраций стремится к осям компонентов, но не достигает их;
4. Типовые сплавы системы.
а) Чистые компоненты, кристаллизуются при постоянной температуре, на рис 5.3 б показана кривая охлаждения компонента А.
б). Эвтектический сплав – сплав, соответствующий концентрации компонентов в точке с (сплав I). Кривая охлаждения этого сплава, аналогична кривым охлаждения чистых металлов (рис. 5.3 б)
Эвтектика – мелкодисперсная механическая смесь разнородных кристаллов, кристаллизующихся одновременно при постоянной, самой низкой для рассматриваемой системы, температуре.
При образовании сплавов механических смесей эвтектика состоит из кристаллов компонентов А и В: Эвт. (кр. А + кр. В)
Процесс кристаллизации эвтектического сплава: до точки 1 охлаждается сплав в жидком состоянии. При температуре, соответствующей точке 1, начинается одновременная кристаллизация двух разнородных компонентов. На кривой охлаждения отмечается температурная остановка, т.е. процесс идет при постоянной температуре, так как согласно правилу фаз в двухкомпонентной системе при наличии трех фаз (жидкой и кристаллов компонентов А и В) число степеней свободы будет равно нулю  . В точке 1/ процесс кристаллизации завершается. Ниже точки 1/ охлаждается сплав, состоящий из дисперсных разнородных кристаллов компонентов А и В.
. В точке 1/ процесс кристаллизации завершается. Ниже точки 1/ охлаждается сплав, состоящий из дисперсных разнородных кристаллов компонентов А и В.
в) Другие сплавы системы аналогичны сплаву II, кривую охлаждения сплава см на рис 5.3.б.
Процесс кристаллизации сплава II: до точки 1 охлаждается сплав в жидком состоянии. При температуре, соответствующей точке 1, начинают образовываться центры кристаллизации избыточного компонента В. На кривой охлаждения отмечается перегиб (критическая точка), связанный с уменьшением скорости охлаждения вследствие выделения скрытой теплоты кристаллизации. На участке 1–2 идет процесс кристаллизации, протекающий при понижающейся температуре, так как согласно правилу фаз в двухкомпонентной системе при наличии двух фаз (жидкой и кристаллов компонента В) число степеней свободы будет равно единице 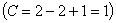 . При охлаждении состав жидкой фазы изменяется по линии ликвидус до эвтектического. На участке 2–2’ кристаллизуется эвтектика (см. кристаллизацию эвтектического сплава). Ниже точки 2’ охлаждается сплав, состоящий из кристаллов первоначально закристаллизовавшегося избыточного компонента В и эвтектики.
. При охлаждении состав жидкой фазы изменяется по линии ликвидус до эвтектического. На участке 2–2’ кристаллизуется эвтектика (см. кристаллизацию эвтектического сплава). Ниже точки 2’ охлаждается сплав, состоящий из кристаллов первоначально закристаллизовавшегося избыточного компонента В и эвтектики.
Схема микроструктуры сплава представлена на рис. 5.4.

Рис. 5.4. Схема микроструктур сплавов: а – доэвтектического, б – эвтектического, в – заэвтектического
5. При проведении количественного структурно-фазового анализа, конода, проведенная через заданную точку, пересекает линию ликвидус и оси компонентов, поэтому состав твердой фазы или 100 % компонента А, или 100 % компонента В.
Диаграмма состояния сплавов с ограниченной растворимостью компонентов в твердом состоянии
Диаграмма состояния и кривые охлаждения типичных сплавов системы представлены на рис.5.5.
1. Количество компонентов: К = 2 (компоненты А и В);
2. Число фаз: f = 3 (жидкая фаза и кристаллы твердых растворов  (раствор компонента В в компоненте А) и
(раствор компонента В в компоненте А) и  (раствор компонента А в компоненте В));
(раствор компонента А в компоненте В));
3. Основные линии диаграммы:
· линия ликвидус acb, состоит из двух ветвей, сходящихся в одной точке;
· линия солидус аdcfb, состоит из трех участков;
· dm – линия предельной концентрации компонента В в компоненте А;
· fn – линия предельной концентрации компонента А в компоненте В.
4. Типовые сплавы системы.
При концентрации компонентов, не превышающей предельных значений (на участках Аm и nВ), сплавы кристаллизуются аналогично сплавам твердым растворам с неограниченной растворимостью, см кривую охлаждения сплава I на рис. 5.5 б. При концентрации компонентов, превышающей предельные значения (на участке dcf), сплавы кристаллизуются аналогично сплавам механическим смесям, см. кривую охлаждения сплава II на рис. 5.5 б.
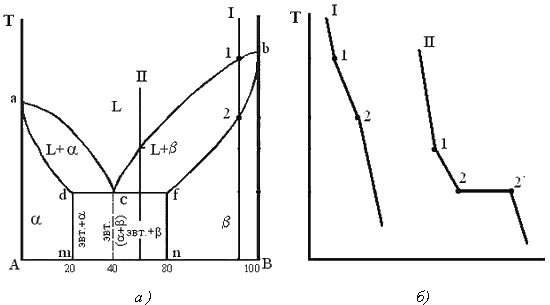
Рис. 5.5 Диаграмма состояния сплавов с ограниченной растворимостью компонентов в твердом состоянии (а) и кривые охлаждения типичных сплавов (б)
Сплав с концентрацией компонентов, соответствующей точке с, является эвтектическим сплавом. Сплав состоит из мелкодисперсных кристаллов твердых растворов  и
и  , эвт. (кр. тв. р-ра
, эвт. (кр. тв. р-ра  + кр. тв. р-ра
+ кр. тв. р-ра  )
)
Кристаллы компонентов в чистом виде ни в одном из сплавов не присутствуют.
Диаграмма состояния сплавов, компоненты которых образуют химические соединения.
Диаграмма состояния сплавов представлена на рис. 5.6.

Рис. 5.6. Диаграмма состояния сплавов, компоненты которых образуют химические соединения
Диаграмма состояния сложная, состоит из нескольких простых диаграмм. Число компонентов и количество диаграмм зависит от того, сколько химических соединений образуют основные компоненты системы.
Число фаз и вид простых диаграмм определяются характером взаимодействия между компонентами.
Эвт1 (кр. А + кр. AmBn);
Эвт2 (кр. B + кр. AmBn).
Диаграмма состояния сплавов, испытывающих фазовые превращения в твердом состоянии (переменная растворимость)
Диаграмма состояния представлена на рис. 5.7.
По внешнему виду диаграмма похожа на диаграмму состояния сплавов с ограниченной растворимостью компонентов в твердом состоянии. Отличие в том, что линии предельной растворимости компонентов не перпендикулярны оси концентрации. Появляются области, в которых из однородных твердых растворов при понижении температуры выделяются вторичные фазы.
На диаграмме:
· df – линия переменной предельной растворимости компонента В в компоненте А;
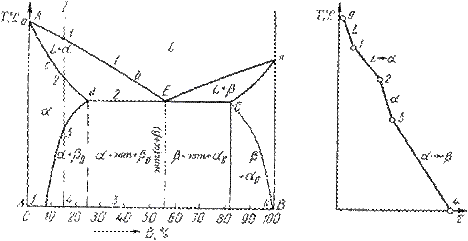 · ek – линия переменной предельной растворимости компонента А в компоненте В.
· ek – линия переменной предельной растворимости компонента А в компоненте В.
Кривая охлаждения сплава I представлена на рис. 5.7 б.
Рис. 5.7. Диаграмма состояния сплавов, испытывающих фазовые превращения в твердом состоянии (а) и кривая охлаждения сплава (б)
Процесс кристаллизации сплава I: до точки 1 охлаждается сплав в жидком состоянии. При температуре, соответствующей точке 1, начинают образовываться центры кристаллизации твердого раствора  . На участке 1–2 идет процесс кристаллизации, протекающий при понижающейся температуре. При достижении температуры соответствующей точке 2, сплав затвердевает, при дальнейшем понижении температуры охлаждается сплав в твердом состоянии, состоящий из однородных кристаллов твердого раствора
. На участке 1–2 идет процесс кристаллизации, протекающий при понижающейся температуре. При достижении температуры соответствующей точке 2, сплав затвердевает, при дальнейшем понижении температуры охлаждается сплав в твердом состоянии, состоящий из однородных кристаллов твердого раствора  . При достижении температуры, соответствующей точке 3, твердый раствор
. При достижении температуры, соответствующей точке 3, твердый раствор  оказывается насыщенным компонентом В, при более низких температурах растворимость второго компонента уменьшается, поэтому из
оказывается насыщенным компонентом В, при более низких температурах растворимость второго компонента уменьшается, поэтому из  -раствора начинает выделяться избыточный компонент в виде кристаллов
-раствора начинает выделяться избыточный компонент в виде кристаллов  . За точкой 3 сплав состоит из двух фаз: кристаллов твердого раствора
. За точкой 3 сплав состоит из двух фаз: кристаллов твердого раствора  и вторичных кристаллов твердого раствора
и вторичных кристаллов твердого раствора  .
.
Связь между свойствами сплавов и типом диаграммы состояния
Так как вид диаграммы, также как и свойства сплава, зависит от того, какие соединения или какие фазы образовали компоненты сплава, то между ними должна существовать определенная связь. Эта зависимость установлена Курнаковым, (см. рис. 5.8.).

Рис. 5.8. Связь между свойствами сплавов и типом диаграммы состояния
1. При образовании механических смесей свойства изменяются по линейному закону. Значения характеристик свойств сплава находятся в интервале между характеристиками чистых компонентов.
2. При образовании твердых растворов с неограниченной растворимостью свойства сплавов изменяются по криволинейной зависимости, причем некоторые свойства, например, электросопротивление, могут значительно отличаться от свойств компонентов.
3. При образовании твердых растворов с ограниченной растворимостью свойства в интервале концентраций, отвечающих однофазным твердым растворам, изменяются по криволинейному закону, а в двухфазной области – по линейному закону. Причем крайние точки на прямой являются свойствами чистых фаз, предельно насыщенных твердых растворов, образующих данную смесь.
4. При образовании химических соединений концентрация химического соединения отвечает максимуму на кривой. Эта точка перелома, соответствующая химическому соединению, называется сингулярной точкой.
Лекция 6
Нагрузки, напряжения и деформации. Механические свойства.
1. Физическая природа деформации металлов.
2. Природа пластической деформации.
3. Дислокационный механизм пластической деформации.
4. Разрушение металлов.
5. Механические свойства и способы определения их количественных характеристик
Физическая природа деформации металлов.
Деформацией называется изменение формы и размеров тела под действием напряжений.
Напряжение – сила, действующая на единицу площади сечения детали.
Напряжения и вызываемые ими деформации могут возникать при действии на тело внешних сил растяжения, сжатия и т.д., а также в результате фазовых (структурных) превращений, усадки и других физико-химических процессов, протекающих в металлах, и связанных с изменением объема.
Металл, находящийся в напряженном состоянии, при любом виде нагружения всегда испытывает напряжения нормальные и касательные (рис. 6.1.).

Рис.6.1. Схема возникновения нормальных и касательных напряжений в металле при его нагружении
Рост нормальных и касательных напряжений приводит к разным последствиям. Рост нормальных напряжений приводит к хрупкому разрушению. Пластическую деформацию вызывают касательные напряжения.
Деформация металла под действием напряжений может быть упругой и пластической.
Упругой называется деформация, полностью исчезающая после снятия вызывающих ее напряжений.
При упругом деформировании изменяются расстояния между атомами металла в кристаллической решетке. Снятие нагрузки устраняет причину, вызвавшую изменение межатомного расстояния, атомы становятся на прежние места, и деформация исчезает.
Упругая деформация на диаграмме деформации характеризуется линией ОА (рис.6.2.).

Рис.6.2. Диаграмма зависимости деформации металла  от действующих напряжений
от действующих напряжений 
 Если нормальные напряжения достигают значения сил межатомных связей, то наблюдается хрупкое разрушение путем отрыва (рис.6.3.)
Если нормальные напряжения достигают значения сил межатомных связей, то наблюдается хрупкое разрушение путем отрыва (рис.6.3.)
Рис.6.3. Схема упругой деформации и хрупкого разрушения под действием упругих напряжений а – ненапряженная решетка металла; б – упругая деформация; в, г – хрупкое разрушение в результате отрыва
Зависимость между упругой деформацией  и напряжением
и напряжением  выражается законом Гука
выражается законом Гука

где: Е - модуль упругости.
Модуль упругости является важнейшей характеристикой упругих свойств металла. По физической природе величина модуля упругости рассматривается как мера прочности связей между атомами в твердом теле.
Эта механическая характеристика структурно нечувствительна, т. е. термическая обработка или другие способы изменения структуры не изменяют модуля упругости, а повышение температуры, изменяющее межатомные расстояния, снижает модуль упругости.
Пластической или остаточной называется деформация после прекращения действия вызвавших ее напряжений.
При пластическом деформировании одна часть кристалла перемещается по отношению к другой под действием касательных напряжений. При снятии нагрузок сдвиг остается, т.е. происходит пластическая деформация (рис.6.4)
В результате развития пластической деформации может произойти вязкое разрушение путем сдвига.

Рис.6.4. Схема пластической деформации и вязкого разрушения под действием касательных напряжений а – ненапряженная решетка; б – упругая деформация; в – упругая и пластическая деформация; г – пластическая деформация; д, е – пластичное (вязкое) разрушение в результате среза
Природа пластической деформации.
Металлы и сплавы в твердом состоянии имеют кристаллическое строение, и характер их деформации зависит от типа кристаллической структуры и от наличия несовершенств в этой структуре.
Рассмотрим пластическую деформацию в монокристалле.
Пластическая деформация может протекать под действием касательных напряжений и может осуществляться двумя способами.
1. Трансляционное скольжение по плоскостям (рис. 6.5 а). Одни слои атомов кристалла скользят по другим слоям, причем они перемещаются на дискретную величину, равную целому числу межатомных расстояний.
В промежутках между полосами скольжения деформация не происходит. Твердое тело не изменяет своего кристаллического строения во время пластической деформации и расположение атомов в элементарных ячейках сохраняется
Плоскостями скольжения является кристаллографические плоскости с наиболее плотной упаковкой атомов.
Это наиболее характерный вид деформации при обработке давлением.
2. Двойникование – поворот одной части кристалла в положение симметричное другой его части. Плоскостью симметрии является плоскость двойникования (рис. 6.5 б).
Двойникование чаще возникает при пластической деформации кристаллов с объемно-центрированной и гексагональной решеткой, причем с повышением скорости деформации и понижением температуры склонность к двойникованию возрастает.
Двойникование может возникать не только в результате действия внешних сил, но и в результате отжига пластически деформированного тела. Это характерно для металлов с гранецентрированной кубической решеткой (медь, латунь). Двойникованием можно достичь незначительной степени деформации.

| 
|
| а) | б) |
Рис.6.5. Схемы пластической деформации различными способами: а – скольжением; б – двойникованием
Дислокационный механизм пластической деформации.
Пластическая деформация происходит в результате скольжения или двойникования. Ранее предполагали, что при скольжении одна часть кристалла сдвигается относительно другой части на целое число периодов как единое целое. Необходимое для этого напряжение получается на несколько порядков выше действительного сдвигового напряжения.
Для железа теоретическое значение сдвигового напряжения  МПа,
МПа,  .
.
В основу современной теории пластической деформации взяты следующие положения:
· скольжение распространяется по плоскости сдвига последовательно, а не одновременно;
· скольжение начинается от мест нарушений кристаллической решетки, которые возникают в кристалле при его нагружении.
Схема механизма деформации представлена на рис.6.6 а.
В равновесном состоянии дислокация неподвижна. Под действием напряжения экстраплоскость смещается справа налево при незначительном перемещении атомов. Нижняя часть плоскости Р/S (SR) сместится вправо и совместится с нижним краем экстра- плоскости РQ.
QR- остаточная деформация.
При дальнейшем движении дислокация пройдет всю плоскость скольжения и выйдет на поверхность зерна. При этом верхняя часть зерна сдвинута относительно нижней на один межатомный период решетки (рис. 6.6 б).
При каждом перемещении дислокации на один шаг необходимо разорвать связь только между двумя рядами атомов в плоскости Р/S, а не между всеми атомами, расположенными выше и ниже плоскости скольжения. Необходимое сдвиговое напряжение при этом мало, равно практически действительному..
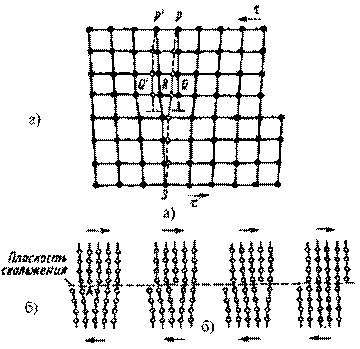
Рис. 6.6. Схема дислокационного механизма пластической деформации а – перемещение атомов при двихении краевой дислокации на одно межатомное расстояние; б – перемещение дислокации через весь кристалл
Разрушение металлов.
Процесс деформации при достижении высоких напряжений завершается разрушением. Тела разрушаются по сечению не одновременно, а вследствие развития трещин. Разрушение включает три стадии: зарождение трещины, ее распространение через сечение, окончательное разрушение.
Различают хрупкое разрушение – отрыв одних слоев атомов от других под действием нормальных растягивающих напряжений. Отрыв не сопровождается предварительной деформацией. Механизм зарождения трещины одинаков - благодаря скоплению движущихся дислокаций перед препятствием (границы субзерен, фазовые границы), что приводит к концентрации напряжений, достаточной для образования трещины. Когда напряжения достигают определенного значения, размер трещины становится критическим и дальнейший рост осуществляется произвольно.
Для хрупкого разрушения характерна острая, часто ветвящаяся трещина. Величина зоны пластической деформации в устье трещины мала. Скорость распространения хрупкой трещины велика - близка к скорости звука (внезапное, катастрофическое разрушение). Энергоемкость хрупкого разрушения мала, а работа распространения трещины близка к нулю.
Различают тр
|
|
|


