 |
Расчеты по уравнениям химических реакций
|
|
|
|
Глава 1. Основные химические понятия
Атом – мельчайшая, химически неделимая частица.
Молекулы состоят из атомов. Н2 – молекула водорода, состоящая из 2 атомов Н – водорода.
| ma(C) = Ar(C)∙ u | где ma(С) – масса атома углерода Ar(C) – относительная атомная масса (см.таблицу Менделеева) u - атомная единица массы (а.е.м.) = 1,66∙10-27 кг = 1,66∙10-24 г |
| Вещества | |
| · Простые ü Металлы ü Неметаллы | · Сложные ü Органические ü Неорганические |
| Вещества характеризуются: | |
| Качественный состав (из каких элементом состоит) | Количественный состав (число атомов каждого элемента) |
| В молекуле: H3PO4 H, P, O | В молекуле: H3PO4 H -3 шт, P- 1 шт, O – 4 шт |
Химическая формула:
 Коэффициент показывает количество молекул, Индекс – количество атомов в одной молекуле. Большинство неметаллов (газы) имеют индекс 2 (H2, O2, CI2, N2, Br2, I2). Молекулы металлов содержат только 1 атом (Na, K, Al, Zn и т.д).
Коэффициент показывает количество молекул, Индекс – количество атомов в одной молекуле. Большинство неметаллов (газы) имеют индекс 2 (H2, O2, CI2, N2, Br2, I2). Молекулы металлов содержат только 1 атом (Na, K, Al, Zn и т.д).
| 3 O2 - три молекулы кислорода 2 О - два атома кислорода |
| Составление химических формул по валентности | Определение валентности элементов в соединениях |
| 1. Записываем символы химических элементов и их валентности: VII II CI O 2. Находим НОК валентностей: VII ∙II = 14 3. Делим НОК на валентность каждого элемента (находим значение индексов) 4. Записываем индексы | 1. Над элементом с постоянной валентностью записываем его значение, над другим – значение обозначим х. х II Cl2O7 2. Составляем равенство: х∙2 = II∙7 3. В формуле вместо х записываем найденное значение валентности. |
| Элементы с постоянной валентностью | |
| H, Li, Na, K, F | I |
| O, Mg, Ca, Ba, Zn | II |
| Al, B | III |
Относительная молекулярная и молярная масса.
M(H3PO4) = Mr(H3PO4)= Ar(H)∙3+ Ar(P)∙1+ Ar(O)∙4
|
|
|
Где M(H3PO4) – молярная масса
Mr(H3PO4) – относительная молекулярная масса
Ar – относительная атомная масса (см. табл.Менделеева)
Массовая доля элемента в соединении (w)
w (A)AxBy = 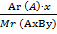
Химическое количество вещества (n) - моль
| n= | Через массу | Через объем (только для газов) | Через количество… (атомов, молекул, ФЕ) | |||
| Числитель | m | Масса вещества (г) | V | Объем | N | Количество… |
| Знаменатель | M | Молярная масса (г/моль) | Vm | Молярный объем 22,4 дм3/моль | Na | Постоянная Авогадро 6,02∙1023 моль-1 |
Глава 2. Химические реакции
| Явления | |
| Физические – это явления, при которых изменяются только форма или агрегатное состояние вещества. | Химические явления (реакции) – явления, при которых происходит превращение одних веществ в другие. |
| Условия протекания: ü Природа реагирующих веществ ü Соприкосновение реагирующих веществ ü Воздействие электрического тока ü Наличие света ü Определенная температура | Признаки химических реакций: ü Выделение газа ü Образование или исчезновение осадка ü Изменение цвета ü Появление запаха ü Излучение света ü Выделение или поглощение тепла |
Химические уравнения. Закон сохранения массы
Масса веществ, вступивших в реакцию, равна массе продуктов реакции..
| 2 H2 +O2 | → | 2H2O |
| Исходные вещества (то что вступает в реакцию) | Конечные продукты (то что получилось в ходе реакции |
*Стрелка между исходными веществами и конечными продуктами указывает направление реакции.
**коэффициенты расставляются для уравнивания количества атомов в левой и правой частях.
Например: 2 H2 (2 молекулы водорода) = 4 H (содержат 4 атома водорода)
2 H2O (2 молекулы воды) = 4 H (содержат 4 атома водорода) и 2 О (2 атома кислорода)
O2 (1 молекула кислорода) = 2 О (2 атома кислорода)
***коэффициенты показывают химическое количество веществ:
| 2 H2 | + | O2 | → | 2H2O |
| 2 моль | 1 моль | 2 моль | ||
| 4 атома водорода | 2 атома кислорода | 2 молекулы воды (4 атома водорода+2 атома кислорода) |
|
|
|
| Типы химических реакций | |
| Соединения | A + B → AB |
| Разложения | AB →A + B |
| Замещения | AB + C → AC + B |
| Обмена | AB +CD → AD +BC AB + C2 → AC +BC |
Расчеты по уравнениям химических реакций
Пример 1. Вычислите объем углекислого газа, образующегося при сгорании метана массой 12 г в кислороде.
| Дано: m(CH4) = 12г | Решение:
1. Записываем уравнение реакции горения метана.
CH4 +O2  CO2 + H2O
*уравниваем
CH4 +O2 CO2 + H2O
*уравниваем
CH4 +O2  CO2 + 2H2O
*подчеркиваем известное и неизвестное
CH4 +O2 CO2 + 2H2O
*подчеркиваем известное и неизвестное
CH4 +O2  CO2 + 2H2O
2. Вычисляем химическое количество известного (метана) CO2 + 2H2O
2. Вычисляем химическое количество известного (метана)
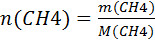 = …
M(CH4) = Mr(CH4) = Ar(C) * 1 + Ar(H) * 4 = 12*1+1*4 = 16 (г/моль)
… = = …
M(CH4) = Mr(CH4) = Ar(C) * 1 + Ar(H) * 4 = 12*1+1*4 = 16 (г/моль)
… =  = 0,75 моль
3. Определяем отношение известного и неизвестного
0,75 моль х моль
CH4 + O2 = 0,75 моль
3. Определяем отношение известного и неизвестного
0,75 моль х моль
CH4 + O2  CO2 + 2H2O
1моль 1 моль
*Составляем пропорцию:
По коэффициентам: из 1 моль CH4 - 1 моль CO2
По условию: из 0,75 моль CH4 - х моль CO2 CO2 + 2H2O
1моль 1 моль
*Составляем пропорцию:
По коэффициентам: из 1 моль CH4 - 1 моль CO2
По условию: из 0,75 моль CH4 - х моль CO2
 = =  х=0,75 моль => n(CO2)
4. Находим объем CO2
т.к. CO2 - газ, то его объем находим по формуле
х=0,75 моль => n(CO2)
4. Находим объем CO2
т.к. CO2 - газ, то его объем находим по формуле 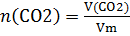 =>
=>  , где n(CO2) = 0,75 моль, а Vm =22,4 дм3/моль – молярный объем , где n(CO2) = 0,75 моль, а Vm =22,4 дм3/моль – молярный объем

|
| Найти V(CO2) -? |
| Глава 3. Кислород | ||
| Физические свойства | Получение | Химические свойства |
| · Простое вещество · Неметалл · При н.у. в газообразном состоянии · Не имеет цвета, вкуса и запаха · tкип = -183°С · tплав = -219°С · плохо растворим в воде | 1. В лабораторных условиях
a. Разложение перманганата калия:
2KMnO4  K2MnO4 + MnO2 + O2↑
b. Разложение пероксида водорода в присутствии катализатора (MnO2)
2H2O2 K2MnO4 + MnO2 + O2↑
b. Разложение пероксида водорода в присутствии катализатора (MnO2)
2H2O2  2H2O + O2↑
c. Электролиз воды
2H2O 2H2O + O2↑
c. Электролиз воды
2H2O  2H2↑ + O2↑
2. В природе:
В процессе фотосинтеза.
6 CO2 + 6H2O 2H2↑ + O2↑
2. В природе:
В процессе фотосинтеза.
6 CO2 + 6H2O  C6H12O6 + 6O2↑
3. В промышленности – из воздуха. C6H12O6 + 6O2↑
3. В промышленности – из воздуха.
| 1. С простыми веществами
С неметаллами (неМе)
S + O2  SO2↑
4P + 5O2 SO2↑
4P + 5O2  P2O5
C металлами (Ме)
2Сu + O2 P2O5
C металлами (Ме)
2Сu + O2  2CuO
3Fe + 2O2 2CuO
3Fe + 2O2  Fe3O4 (FeO∙Fe2O3)
2. Со сложными веществами (горение)
CH4 + O2 Fe3O4 (FeO∙Fe2O3)
2. Со сложными веществами (горение)
CH4 + O2  CO2 +H2O CO2 +H2O
|
*Катализатор – вещество, ускоряющее химическую реакцию, но не расходуемое в ней.
**Соединения элементов с кислородом – оксиды.
Окисление – процесс, в результате которого атом кислорода присоединяется к атому другого элемента.
| Глава 4. Водород | ||
| Физические свойства | Получение | Химические свойства |
| · Простое вещество · Неметалл · При н.у. в газообразном состоянии · Не имеет цвета, вкуса и запаха · tкип = -252°С · tплав = -259°С · плохо растворим в воде | 1. В лабораторных условиях
a. Взаимодействие металла (до водорода*) с кислотой
2Na + 2HCI  2NaCI + H2
b. Электролиз воды
2H2O 2NaCI + H2
b. Электролиз воды
2H2O  2H2↑ + O2↑
2. В промышленности.
CH4 2H2↑ + O2↑
2. В промышленности.
CH4  C + 2H2↑ C + 2H2↑
| 1. С простыми веществами
С неметаллами (неМе)
H2 + CI2  2HCI
H2 + N2 2HCI
H2 + N2  NH3
C металлами (Ме) – образует гидриды
Na +H2 NH3
C металлами (Ме) – образует гидриды
Na +H2  NaH
2. Со сложными веществами (ворует кислород)
CuO + H2 NaH
2. Со сложными веществами (ворует кислород)
CuO + H2  Cu + H2O Cu + H2O
|
|
|
|
*Существует ряд активности металлов:
Li, Rb, K, Ba, Sr, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Cd, Co, Ni, Sn, Pb, H, Sb, Bi, Cu, Hg, Ag, Pd, Pt, Au
Чем левее металл располагается относительно водорода, тем лучше (активнее) он реагирует с кислотами.
Металлы после водорода с кислотами НЕ реагируют.
Кислоты
Кислоты – сложные вещества, в состав которых входят атомы водорода и кислотные остатки.
| Название кислоты | Формула кислоты | Название кислотного остатка |
| Хлороводородная (соляная) | HCI | Хлорид |
| Азотная | HNO3 | Нитрат |
| Сероводородная | H2S | Сульфид |
| Сернистая | H2SO3 | Сульфит |
| Серная | H2SO4 | Сульфат |
| Кремневая | H2SiO3 | Силикат |
| Угольная | H2CO3 | Карбонат |
| Фосфорная | H3PO4 | Фосфат |
*валентность кислотного остатка = количеству атомов водорода в кислоте: в HCI - кислотный остаток CI имеет валентность (I), т.к. в молекуле кислоты только 1 атом водорода, а в молекуле H3PO4 - кислотный остаток PO4 имеет валентность (III).
**для обнаружения кислот используют индикаторы. С кислотами индикаторы лакмус, метилоранж и индикаторная бумага приобретают красную окраску. Фенолфталеин не является индикатором для кислот.
Соли – сложные вещества, состоящие из атомов металлов и кислотных остатков.
|
|
|


