 |
замещения у насыщенного атома углерода
|
|
|
|
МЕТОДИЧЕСКАЯ РАЗРАБОТКА
для проведения занятия со студентами I курса
медико-диагностического факультета
по биоорганической химии
Тема: Реакции элиминирования и нуклеофильного
замещения у насыщенного атома углерода
Время: 3 часа
1. УЧЕБНЫЕ И ВОСПИТАТЕЛЬНЫЕ ЦЕЛИ:
Сформировать знания о конкурентных реакциях SN и Е, протекающих в одной молекуле, но на разных реакционных центрах. Выработать у студентов умение прогнозировать реакционную способность спиртов, аминов, тиолов и галогенпроизводных углеводородов в конкурентных реакциях нуклеофильного замещения и элиминирования в зависимости от строения субстрата и типа реагента.
МОТИВАЦИЯ ДЛЯ УСВОЕНИЯ ТЕМЫ:
Конкурентные реакции SN и Е широко представлены в биологических системах, а также лежат в основе многочисленных промышленных синтезов.
ТРЕБОВАНИЯ К ИСХОДНОМУ УРОВНЮ ЗНАНИЙ:
а) строение двойной связи;
б) электроотрицательность элементов;
в) полярность и поляризуемость связей;
г) электронные эффекты заместителей. Электронодонорные и электроноакцепторные заместители;
д) типы реагентов (нуклеофил). Переходное состояние. Строение карбкатиона и карбаниона. Факторы, влияющие на их стабильность;
е) кислотность и основность органических соединений.
В результате проведения занятия студент должен:
1) знать:
– реакционные центры в молекуле у sp3-гибридного атома углерода, связанного с электроакцепторным заместителем;
– механизм конкурентных реакций нуклеофильного замещения и элиминирования;
– биологические реакции (алкилирование и дегидратация), протекающие по типу SN и Е.
2) уметь:
– находить реакционные центры у насыщенного атома углерода, связанного с электроакцепторным заместителем в молекулах органических соединений;
|
|
|
– описывать механизмы реакций SN и Е, протекающие в биологических системах.
2. СВЯЗЬ СО СМЕЖНЫМИ ДИСЦИПЛИНАМИ:
Полученные знания о конкурентных реакциях, протекающих в одной молекуле, но на разных реакционных центрах потребуются студентам при изучении курсов биохимии, фармакологии.
3. КОНТРОЛЬНЫЕ ВОПРОСЫ ПО ТЕМЕ ЗАНЯТИЯ:
3.1 Реакции нуклеофильного замещения в ряду алкилгалогенидов, спиртов, тиолов, аминов.
3.2 Реакции β-элиминирования как наиболее распространенный тип элиминирования, протекающий в живых организмах и приводящий к образованию кратной связи.
4. ХОД ЗАНЯТИЯ:
4.1. Реакции нуклеофильного замещения (SN)
К конкурентным реакциям у насыщенного атома углерода относятся реакции нуклеофильного замещения и элиминирования.
Конкурентные реакции SN и Е протекают в одной молекуле, но на разных реакционных центрах. Они протекают с участием нуклеофила у sp3-гибридного атома углерода, связанного полярной связью (σ-связью) с заместителем.
Нуклеофильное замещение при насыщенном атоме углерода характерно для алкилгалогенидов, спиртов, тиолов, аминов.

Введение в насыщенный углеводородный скелет молекулы электроакцепторной группировки Х приводит к перераспределению электронной плотности в молекуле и появлению новых реакционных центров.


В продукте реакции новая связь образуется за счет электронной пары, которую приносит нуклеофил, а к уходящей группе переходят электроны бывшей связи С–Х.
Реакция возможна, т.е. протекает вправо, когда уходящая группа более стабильна, чем нуклеофил, т.е. имеет меньшую энергию по сравнению с атакующим нуклеофилом.

Образование молочной кислоты, протекающей по механизму SN.


Вначале нуклеофильная частица Y‾ атакует атом углерода с наиболее выгодной стороны (противоположной уходящей группе «атака с тыла»). Разрыв старой связи С–Х и образование новой С–Y происходит синхронно, т.е. образуется переходное состояние (в этой стадии принимают участие две молекулы – реагент и субстрат). Реакция бимолекулярная, скорость реакции зависит от концентрации обоих реагентов. Переходное состояние соответствует максимуму на энергетической кривой.
|
|
|
Протекание реакции нуклеофильного замещения приводит к «обращению» конфигурации атома углерода (т.е. происходит изменение положения заместителей в пространстве).

Нуклеофильное замещение в спиртах, тиолах и аминах протекает аналогично, но эти соединения содержат довольно трудноуходящие группы (ОН‾, SH‾, NН2‾) и данные реакции протекают, как правило, в условиях кислотного катализа, при этом трудноуходящая группа превращается в легкоуходящую ХН.
Потенциальные субстраты в SN реакциях


Примеры реакций SN у sр3 гибридного атома углерода (in vitro)

4.2. Реакции элиминирования
Реакция элиминирования(Е) заключается в отщеплении двух атомов или групп, входящих в состав одной молекулы.
Различают α-, β- и γ-элиминирование.
α-элиминирование – отщепление двух атомов или групп атомов происходит от одного и того же атома углерода.
β-элиминирование – отщепление двух атомов или групп атомов происходит от соседних атомов углерода.
β-элиминирование наиболее распространенный тип элиминирования, протекающий в живых организмах и приводящий к образованию кратной связи.
Схема реакции Е:
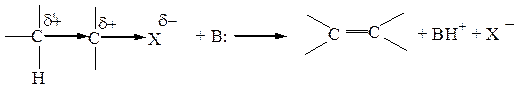
У β-углеродного атома возникает СН-кислотный центр. Каждый нуклеофил в то же время является и основанием, и если его основные свойства значительны, он может вытолкнуть не только уходящую группу, но и оторвать подвижный протон от β-углеродного атома.



Одной из реакций элиминирования, имеющих биологическое значение – является реакция дегидратации (отщепление воды).

Гидроксид-ион относится к плохо уходящим группам, поэтому для того, чтобы реакция протекала в прямом направлении необходимо трудно уходящую группу (ОН‾) превратить в хорошо уходящую (Н2О). Это осуществляется в условиях кислотного катализа.
|
|
|
Механизм реакции:
В кислой среде не может быть сильного основания, поэтому процесс пойдет в несколько стадий.
1 стадия

2 стадия
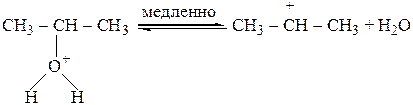
3 стадия
На третьей стадии вода выступает в роли основания и принимает протон от СН-кислотного центра.

Правило Зайцева: в реакциях дегидрогалогенирования и дегидратации, водород отщепляется от наименее гидрогенизированного атома углерода.
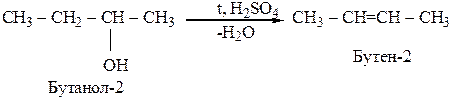
Дегидратация характерна для соединений живой природы, содержащих гидроксильную группу и СН-кислотный центр.
5. вопросы ДЛЯ САМОконтроля знаний:
1. Получите α-аминокислоту глицин из хлоруксусной кислоты. Объясните механизм реакции.
2. Природные α-гидроксикислоты получаются действием водного раствора щелочи на α-галогенкарбоновые кислоты. Синтезируйте молочную кислоту из соответствующих реагентов.
3. Бензилйодид является сильным лакриматором («полицейский слезоточивый газ»). Получите бензилйодид из бензилового спирта. Опишите механизм реакции.
4. Диэтиловый эфир (средство для наркоза) получается действием натрия этилата на этилйодид. Напишите схему реакции. Что является нуклеофилом в данной реакции и по какому механизму она протекает?
5. Напишите схему реакции дегидратации этилового спирта. Опишите по стадиям механизм реакции. В какой среде происходит отщепление воды от спиртов?
6. Какой продукт получается при действии на пропилбромид концентрированного спиртового раствора калий гидроксида? Напишите схему реакции и объясните механизм.
6. ЛИТЕРАТУРА
ОСНОВНАЯ:
1. Конспект лекций.
2. Тюкавкина, Н.А. Биоорганическая химия: учебник для вузов/ Н.А. Тюкавкина, Ю.И. Бауков. – 4-е изд. – М.: Дрофа, 2005. – С. 149-181.
3. Руководство к лабораторным занятиям по биоорганической химии: учеб. пособие/ Н.Н. Артемьева [и др.]: под ред. Н.А. Тюкавкиной. – М: Медицина, 1999. – С. 81-94.
ДОПОЛНИТЕЛЬНАЯ:
1.Слесарев, В.И. Основы химии живого: учебник для вузов/ В.И. Слесарев. – СПб.: Химиздат, 2001. – С. 426-448.
2. Зеленин, К.Н. Химия: учебник для медицинских вузов/ К.Н. Зеленин. – СПб.: Специальная Литература, 1997. – С. 449-461.
|
|
|
Авторы: Зав. кафедрой, доцент, к.х.н. Лысенкова А.В., доцент, к.х.н. Филиппова В.А., ст. преподаватели Одинцова М.В., Чернышева Л.В., Довнар А.К., ассистенты Перминова Е.А., Прищепова И.В., Зыкова Е.Л.
20.01.2017
|
|
|


