 |
Взаимодействие слабой кислоты и сильного основания.
|
|
|
|
Реакции ионного обмена
| Выполнил: | Равилов А.И. | ____________________________ (подпись) |
| студент 1 курса РДБ-13-1 | ||
| Принял: доцент кафедры квантовой физики и нанотехнологий ____________________________ (дата) | С.А. Скорникова | ____________________________ (подпись) |
Иркутск 2013
ИОННЫЕ РЕАКЦИИ
Приборы и посуда: нагревательные приборы, мерный цилиндр емкостью 20 мл, шпатели, штативы с пробирками, стеклянные палочки.
Реактивы и материалы: оксалат кальция СаС2О4, индикаторная бумага.
Растворы: соляная кислота HCl (2н и 1,18 г/см3); серная кислота H2SO4 (2н) и 1:1 азотная кислота HNO3 (ρ =1,4 г/см3); уксусная кислота СН3СООН (2н); гидроксид натрия NaOH (2н); гидроксид калия –КOH (2н); хлорид калия KCl (насыщ.); ацетат натрия CH3COONa (2н); сульфат натрия Na2 SO4 (2н); сульфид натрия Na2S (1н); хлорид бария BaCl2 (0,5 н и насыщ.); хлорид стронция SrCl2 (0,5н); сульфат стронция SrSO4 (насыщ.); хлорид кальция CaCl2 (0,5н); сульфат кальция CaSO4 (насыщ.); хлорид меди (II) CuCl2 (0,5 н); сульфат цинка ZnSO4 (0,5н); сульфат марганца (II) MnSO4 (0,5 н); гидрооксид бария Ba(OH)2 (насыщ.); насыщенный раствор Са(ОН)2 (известковая вода); нитрат свинца (II) Pb(NO3)2 (1н); хромат калия K2CrO4 (1н); хлорид аммония NH4Cl (0,2н).
Опыт 1. Влияние концентрации ионов на образование и растворение осадков.
В две пробирки налейте насыщенный раствор Са(ОН)2 (известковая вода). В первую пробирку добавьте 2н. раствор NaOH, во вторую – CaCl2.
1) 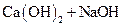 – реакция не идёт, гидроксид кальция (малорастворимая щелочь) не взаимодействует с гидроксидом натрия (растворимая щелочь).
– реакция не идёт, гидроксид кальция (малорастворимая щелочь) не взаимодействует с гидроксидом натрия (растворимая щелочь).
2) 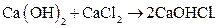
Прилейте в каждую из пробирок раствор HCl, наблюдая за изменениями.
1) 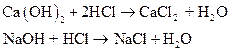 – помутнение.
– помутнение.
2)  – пузырится.
– пузырится.
Опыт 2. Ионные реакции с образованием труднорастворимых солей.
|
|
|
Налейте в три пробирки по 2 – 3 мл растворов хлоридов бария, стронция и кальция. В первую пробирку прилейте раствор сульфата натрия, во вторую – насыщенный раствор сульфата кальция, в третью – насыщенный раствор сульфата стронция. Что наблюдается?
1) 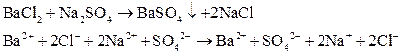 – белый осадок.
– белый осадок.
2) 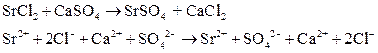
3)  – бледно-белый.
– бледно-белый.
Опыт 3. Ионные реакции с образованием труднорастворимых солей.
В две пробирки налейте по 1 – 2 мл раствора нитрата свинца (II) Pb(NO3)2. В одну пробирку добавьте такой же объем раствора сульфата натрия, в другую – раствора хромата калия K2CrO4.
1) 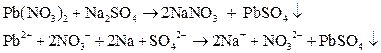 – белый осадок.
– белый осадок.
2)  – жёлтый осадок.
– жёлтый осадок.
В третью пробирку налейте по 1 мл растворов сульфата натрия и хромата калия, перемешайте стеклянной палочкой и добавьте немного раствора нитрата свинца.
3) 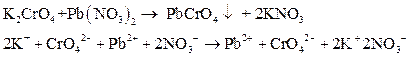
4) 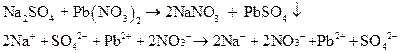
Опыт 4. Влияние произведения растворимости сульфидов на их отношение к кислотам.
Получите осадки сульфидов марганца (II) и меди (II). Подействуйте на них 2н раствором HCl.
1) 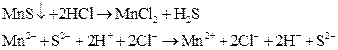
2) 
Опыт 5. Ионные реакции с образованием слабых электролитов.
1) В пробирку налейте 1 – 2 мл раствора ацетата натрия, добавьте немного серной кислоты (1:1), перемешайте раствор стеклянной палочкой и слегка подогрейте.
Наблюдаем образование летучей слабой уксусной кислоты 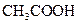 :
:
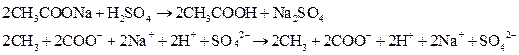
2) К раствору хлорида аммония добавьте немного раствора гидроксида натрия и осторожно подогрейте раствор.
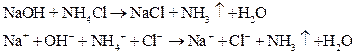 – выделяется аммиак.
– выделяется аммиак.
3) В пробирку внесите немного сухого оксалата кальция СаС2О4 и добавьте соляную кислоту.
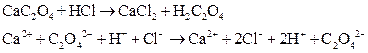
Опыт 6. Реакции нейтрализации.
1) Взаимодействие сильной кислоты и сильного основания. Налейте в фарфоровую чашку 5 мл 2н. раствора HCl и прибавьте к нему по каплям 2н раствор NaOH. Раствор перемешивайте стеклянной палочкой и определяйте характер его среды, перенося каплю раствора на индикаторную бумагу. Опыт продолжите до получения нейтральной среды раствора. Полученный раствор выпарьте досуха.
 – при выпаривании получается соль
– при выпаривании получается соль 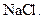
|
|
|
Взаимодействие слабой кислоты и сильного основания.
Налейте в пробирку 2 мл 2н раствора щелочи и добавьте одну каплю фенолфталеина  . Добавляйте по каплям 2н раствор уксусной кислоты до обесцвечивания раствора.
. Добавляйте по каплям 2н раствор уксусной кислоты до обесцвечивания раствора.
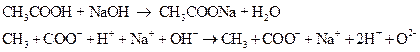 – образуется ацетат натрия.
– образуется ацетат натрия.
Опыт 7. Тепловой эффект реакции нейтрализации.
1) Отмерьте по 20 мл. 2н. растворов NaOH и HCl. Налейте растворы в два стакана и измерьте температуру. Смешайте кислоту со щелочью в одном из стаканов и осторожно перемешайте жидкость термометром.
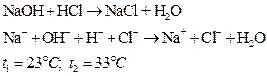
2) Повторите предыдущий опыт, взяв 2н. растворы другой щелочи (например, КОН) и другой сильной кислоты (например, H2SO4).
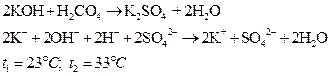
Опыт 8. Получение и свойства амфотерного гидроксида.
Из имеющихся в лаборатории реактивов получите осадок гидрооксида цинка. Взболтайте полученную суспензию и разделите на две пробирки. В одну из них добавьте раствор HCl, в другую – избыток раствора NaOH.
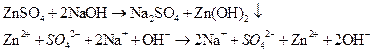
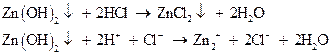 – бледно-белый осадок.
– бледно-белый осадок.
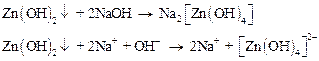 – осадок растворился.
– осадок растворился.
|
|
|


