 |
Изучение свойств d – элементов.
|
|
|
|
Севмашвтуз
Кафедра «Инженерная защита окружающей среды и реновации техники»
Т.И.Белозёрова
Общая и неорганическая химия
Методические указания по выполнению лабораторных работ №16 и №17
«Химические свойства железа, кобальта, никеля и их соединений».
«Химические свойства хрома, марганца и их соединений»
Количество часов,
планируемые на работу – 4 часа
г.Северодвинск
УКД 557
Белозёрова Т.И.
Общая и неорганическая химия
Методические указания по выполнению лабораторных работ №16 и №17
«Химические свойства хрома, марганца и их соединений»
«Химические свойства железа, кобальта, никеля и их соединений».
По дисциплине «Общая и неорганическая химия»
Северодвинск, Севмашвтуз 2004 г. - …с
Методические указания к лабораторным занятиям по дисциплине «Общая и неорганическая химия» разработаны для студентов специальности 330200
Рассмотрены вопросы взаимодействия металлов с кислотами, свойства гидроксидов, комплексные соединения данных металлов.
Биологическая роль d – элементов и их соединений.
Министерство образования Российской Федерации
Санкт – Петербургский Морской Технический университет
Севмашвтуз
Кафедра «Инженерная защита окружающей среды и реновации техники»
Методические указания по выполнению лабораторных работ №16 и №17
«Свойства хрома, марганца и их соединений»
«Свойства железа, кобальта, никеля и их соединений»
Индекс 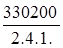 о.ф.о. 2000 г.
о.ф.о. 2000 г.
Количество часов,
планируемые на работу – 4 часа
г.Северодвинск
|
|
|
2004 г.
Введение
Целью методического указания, рассчитанного на 4 часа, является систематизация и закрепление теоретических знаний, получаемых на лекционных занятиях по этой дисциплине. В методических указаниях предложены контрольные вопросы по изучаемой теме, что позволяет студентам лучше усвоить данный материал.
I. Цель работы: Изучить свойства d – элементов.
II. Рабочее задание.
Проделать опыты. Ответить на контрольные вопросы.
III. Общие сведения.
Марганец, железо, кобальт, никель находятся в первой вставной декаде периодической системы. Строение внешних электронных оболочек атомов 3dk4s2(где k = 5 – 8).Характерные степени окисления(в скобках указаны типичные соединения): для марганца +2(соли Mn+2), +4(MnO2), +6(соли H2MnO4), +7(соли HMnO4); для железа +2 (соли Fe+2), +3(соли Fe+3), +6(соли H2FeO4); для кобальта+2(солиCo+2); +3(комплексы Co+3); для никеля +2(соли Ni+2); +3[Ni(OH)3]. В соответствии с ростом заряда ядра в ряду элементовMn – Ni упрочняется связь валентных электронов с ядром и вследствие этого стабилизируется низкие степени окисления элементов и дестабилизируются высокие.
Марганец, железо, кобальт, никель – белые твёрдые металлы, имеющие высокие температуры плавления (соответственно 1244, 1536, 1493 и 1453ºС) и высокие плотности (соответственно 7,47, 7,91, 8,90 и 8,90 г/см3).
Соли Mn+2 имеют светло – розовую окраску (в разбавленных растворах практически бесцветны), многие из них хорошо растворимы в воде, гидролиз их незначителен.
Ион Mn+2 образует менее прочные комплексы, чем Fe+2, Co+2, Ni+2. Такая закономерность объясняется электронным строением Mn+2 (d – орбитали иона одинаково заполнены (на каждой орбитали находится по одному электрону). Поэтому энергетический эффект, обусловленный расщеплением уровней энергии d – электронов под действием поля лигандов, для иона Mn+2 равен нулю и склонность к комплексообразованию Mn+2 примерно такая же, как у двухзарядных ионов благородногазовой конфигурации, имеющих сходные с Mn+2 радиусы.
|
|
|
Одним из наиболее устойчивых соединений Мn+4 является диоксид MnO2 - бурое или чёрное вещество (в зависимости от условий получения). Соли Mn+4 в водном растворе почти полностью гидролизируются с образованием гидротированного оксида MnO2·x H2O.
Марганец (VI) образует анион MnO  ; соли, содержащие этот анион, называются манганатами. Манганаты имеют зелёную окраску. Они образуются при сплавлении MnO2 с щелочами в присутствие окислителей. Манганаты устойчивы только в щелочной среде, в нейтральных и кислых средах происходит диспропорционирование ионов:
; соли, содержащие этот анион, называются манганатами. Манганаты имеют зелёную окраску. Они образуются при сплавлении MnO2 с щелочами в присутствие окислителей. Манганаты устойчивы только в щелочной среде, в нейтральных и кислых средах происходит диспропорционирование ионов:
3MnO  +2 H2O→ 2 MnO
+2 H2O→ 2 MnO  + MnO2↓+4ОН
+ MnO2↓+4ОН 
Марганец (VII) образует перманганат - ион MnO  , имеющий в водном растворе интенсивную красно – фиолетовую окраску. Перманганаты – одни из наиболее сильных окислителей.
, имеющий в водном растворе интенсивную красно – фиолетовую окраску. Перманганаты – одни из наиболее сильных окислителей.
При переходе от Fe к Ni стабильность степени окисления +3 уменьшается. Так, Fe(OH)2 мгновенно окисляется кислородом воздуха, окисление Со(ОН)2 идёт медленно, а Ni(OH)2 с кислородом вообще не реагирует и Ni(OH)3 может быть получен только при действии очень сильных окислителей на Ni(OH)2.
Соли Fe+3 в водных растворах гидролизируются, в результате чего образуются полиядерные комплексы [Fe2(OH) 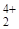 и др.], устойчивые в растворе при комнатной температуре. При кипячении разбавленных растворов, содержащих Fe3+, осаждается Fe(OH)3.
и др.], устойчивые в растворе при комнатной температуре. При кипячении разбавленных растворов, содержащих Fe3+, осаждается Fe(OH)3.
Известно много комплексов Fe, Co, Ni. Особенно прочные комплексы с рядом лигандов (NH3 и его производные, СN  и др.) образует Co+3(конфигурация d6). Комплексы Co+3 обычно получают окислением соединений Co+2 в присутствии соответствующего лиганда.
и др.) образует Co+3(конфигурация d6). Комплексы Co+3 обычно получают окислением соединений Co+2 в присутствии соответствующего лиганда.
Гидротированные ионы Fe2+, Fe+3 имеют очень слабую окраску (соответственно зелёную и фиолетовую). В растворах эта окраска незаметна, её можно наблюдать в обогащённых водой кристаллогидратах, содержащих Fe2+, Fe+3. Растворы солей Fe+3 обычно окрашены в бурый цвет, обусловленный продуктами гидролиза ионов Fe+3.
Окраска соединений кобальта зависит от координационного (к.ч.) Co+2. Если к.ч.=4 (например, в [СоСl4]2-), то соединение ярко – синее, при к.ч.=6 (например, в [Со(Н2О)6]2+) окраска розовая. Данная закономерность обусловлена тем, что расщепление энергетических уровней d – электронов в тетраэдрическом поле лигандов значительно меньше, чем в октаэдрическом.
|
|
|
Соединения Ni2+ обычно имеют зелёную окраску.
Марганец входит в состав многих металлоферментов растений и животных. Марганец присутствует в большинстве почв. Обычно его содержание колеблется в пределах 20 – 200 мг/кг. Недостаток марганца в почве проявляется в заболеваниях растений, связанных с замедлением работы цикла Кребса – один из важнейших циклов любой живой клетки, вырабатывающей энергию и запасающей её в АТФ.
Железо играет активную роль в жизнедеятельности любых организмов. Оно образует ферменты, стимулирующие окислительно – восстановительные процессы. Велика роль железа в вопросах фотосинтеза и динамики растений.
IV. Объект исследования.
Изучение свойств d – элементов.
|
|
|


