 |
Глава 3. Трансмиокардиальная лазерная реваскуляризация миокарда.
|
|
|
|
По данным Всемирной организации здравоохранения на долю ишемической болезни сердца приходится до 60% смертельных исходов от всех видов сердечно-сосудистых заболеваний. Долгое время единственным радикальным средством лечения данной болезни являлась операция аорто-коронарного шунтирования АКШ (введение обходных путей для коронарной артерии), а также транслюминальная баллонная ангиопластика. Начало экспериментальным исследованиям альтернативных методов восстановления кровоснабжения миокарда положили работы 1933-1935 гг. [5]. В них изучалась теоретическая возможность поступления крови в миокард прямо из полости левого желудочка по специально созданным каналам. В 1981 году M. Mirhoseini и M. Cayton [6,7] предложили формировать каналы в миокарде с помощью СО2 лазера. В 1993 г., на конгрессе сердечно-сосудистых хирургов в Барселоне, трансмиокардиальная лазерная реваскуляризация (ТМЛР) официально была признана третьим альтернативным методом реваскуляризации миокарда.
Первоначально процедура ТМЛР производилась преимущественно одновременно с АКШ и использованием искусственного кровообращения. С созданием новых высокоэнергетичных СО2-лазеров (мощность в импульсе до 1000 Вт) появилась возможность создавать лазерные каналы в миокарде в течение одного сердечного сокращения, то есть выполнять операцию на бьющемся сердце, что послужило новым толчком к дальнейшему развитию метода.
Число подобных операций в мире неуклонно растет. С 300 операций ТМЛР в 1995 году к концу 1998 года выполнено около 4 тысяч, а к 2013 г. до 40 тысяч подобных вмешательств. Проведения процедуры TMLR через световод, введенный с помощью катетера в левый желудочек (световодно-катетерный метод) через прокол в периферической артерии может составить в будущем серьезную конкуренцию лазерно-хирургической методике TMR-процедуры [8].
|
|
|
Операции ТМЛР в нашей стране начаты в 1996 г. по инициативе директора Научного Центра сердечно-сосудистой хирургии им. А.Н.Бакулева, академика РАМН Л.А.Бокерия. Первый отечественный образец высокоэнергетической ЭКГ-синхронизированной лазерной СО2-установки (Геном-4) кардиохирургических систем серии «Перфокор» создан в ИПЛИТ РАН под руководством академика РАН В.Я.Панченко в 1996 [9]. Были разработаны собственные критерии эффективности операции, предоперационные контрольные тесты, определены оптимальные режимы работы лазера и выработаны критерии использования лазерных установок в клинике. Первая операция ТМЛР на бьющемся сердце с помощью СО2-лазера была выполнена 27 апреля 1997 года в НЦ ССХ им. А.Н.Бакулева РАМН.
В процессе операции по методу ТМЛР, в толще сердечной мышцы левого желудочка с помощью мощного лазерного излучения создаются каналы, открывающиеся в полость сердца. Эти каналы способствуют восстановлению кровообращения в ишемизированных зонах миокарда и предотвращают развитие инфаркта миокарда (рис.1). Операция происходит на работающем сердце без использования аппарата искусственного кровообращения, относительно малотравматична, а время непосредственно "лазерной" части не превышает, как правило, 30 минут. В отдельных случаях возможно совмещение метода TMLR и байпасной хирургии.
Рис.1 Схема процедуры ТМЛР.
 | |||||
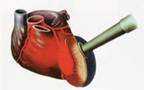 | 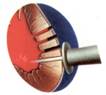 | ||||
| Манипулятор подводится к открытому работающему сердцу | Лазерный луч пробивает сквозные каналы | Быстрое закрытие каналов коагуляцией с последующим восстановлением кровообращения за счет процесса неоангиогенеза | ||||
|
|
|
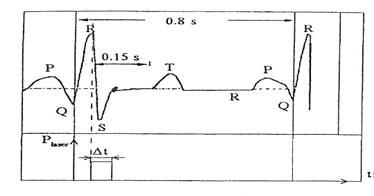
Канал в миокарде формируется за один мощный лазерный импульс или серию коротких импульсов. Импульс синхронизируется с R-зубцом электрокардиограммы (рис. 2.) и может продолжаться до Т-зубца (около 150 мс), т.е. время воздействия излучения ограничено интервалом между двумя сокращениями сердца. В этот момент левый желудочек сердца полностью наполнен кровью, поглощающей часть прошедшего через канал излучения, что предохраняет от повреждения внутренние структуры сердца. При этом риск возникновения наведенной аритмии вследствие ударного воздействия лазерного импульса сводится к минимуму. Вероятность этого, по данным исследователей Texas Heart Institute, составляет для эксимерного лазера 67%, Ho:YAG-55% и СО2 лазера - 3%. Показания к процедуре ТМЛР: выраженная клиника стенокардии, наличие в области операции жизнеспособного миокарда или зоны ишемии.
Рис.2. Типичная электрокардиограмма сердца человека.
 |
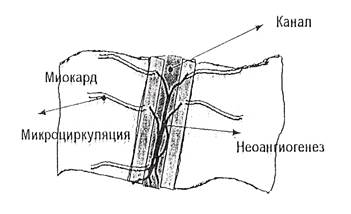
Классическая гипотеза механизма ТМЛР основывается на миокардиальной циркуляции рептилий, у которых кровь поступает непосредственно из полости левого желудочка. Сегодня в литературе существует несколько теорий, объясняющих эффективность ТМЛР, и наиболее часто обсуждаема концепция ангиогенеза. После ТМЛР в миокарде происходят репаративные процессы, ведущие к образованию фиброза и росту новых сосудов (рис.3.), которые, очевидно, и представляют основу клинического улучшения.
В монографии «Трансмиокардиальная лазерная реваскуляризация» [10] впервые в комплексе освещены все аспекты ТМЛР, начиная с лазеров по ТМЛР и их взаимодействия с тканями до перспектив развития метода.
Рис. 3. Рост микрососудов (неоангиогенез) в области лазерного канала.
Физико-биологические механизмы перфорации глубоких каналов при процедуре ТМЛР.
Процесс формирования глубокого канала под действием высокоинтенсивного лазерного излучения сопровождается разрушением ткани в области воздействия излучения (создается лазерный канал), тепловым и ударно-волновым (механическим) повреждением окружающих канал тканей (рис. 4).
Глубина и степень тепловых повреждений ткани определяется как оптическими и теплофизическими свойствами самих тканей, так и параметрами лазерного излучения. Важным фактором в регуляции размеров зоны термоповреждения (ЗТП) является интенсивность кровотока, который регулирует теплопередачу в области перфорирования. ЗТП включает в себя зону коагуляции и зону некроза - карбонизации.
|
|
|
Рис. 4. Эффекты, сопровождающие формирование глубокого лазерного канала в биоткани.
 |
Изучение коагуляционной зоны с помощью электронной микроскопии показало, что границы области гомогенизации ткани (в результате нагрева лазерным излучением) с размытыми очертаниями клеток и разрушенными кровеносными сосудами совпадают с визуально обнаружимыми границами ткани белесого цвета. Изменение цвета ткани из-за денатурации белка происходит при температуре выше 60 С (60¸70°С для времени нагрева 1 – 100 мс). Более значительный нагрев ткани, до температуры 300-400 С, приводит к ее карбонизации. Размеры зоны карбонизации можно определить визуально (обычный микроскоп), как граничащий с абляционной зоной слой ткани темно-коричневого цвета. Основные компоненты миокарда, мышечные ткани и коллаген, имеют анизатропную субклеточную структуру. Теплопередача вдоль мышечных волокон существенно выше, чем между волокнами, разделенными межклеточным пространством и коллагеном, обеспечивающим термобарьер. Поэтому ЗТП в поперечном сечении лазерного канала имеет неправильную форму, вытянутую в направлении ориентации мышечных волокон.
Перфорация миокарда сопровождается умеренными тепловыми и ударно-волновыми воздействиями на окружающие лазерный канал ткани. При таких давлениях полностью исключается риск наведенной аритмии сердца; при этом возможны локальные микроразрывы стенок канала в связи с низким значением предела прочности мышечной ткани на разрыв, наблюдается формирование «древообразного» теплового воздействия на стенки канала. Результаты измерений степени теплового и ударно-волнового (по акустическому сигналу и давлению отдачи) воздействий на стенки лазерного канала представлены в табл. 1.
|
|
|
Таблица 1. Параметры перфорации миокарда импульсами установки серии «Перфокор».
| T pulse, мс | 30-50 |
| E pulse, Дж | 20-25 |
| Зона обугливания, мкм | до 30-40 |
| Зона коагуляции, мкм | до 150-200 |
| Давление в канале, атм | до 0,3 |
К числу возможных механизмов положительного эффекта ТМЛР относят:
1) воспалительная реакция в ответ на формирование лазерной раны (канала) приводит к регенерации и развитию капилляров;
2) тепловое повреждение ткани в области канала приводит к активации клеточных элементов (тромбоцитов, фибробластов, макрофагов и др.), как источников комплекса факторов роста, в частности, фактора роста сосудистого эндотелия и фибробластов;
3) образование микроразрывов в стенках канала и установление нового уровня потребления кислорода в области канала способствует развитию капилляров;
4) главный механизм – запуск процесса ангиогенеза, который восстанавливает сосудистую структуру сердца.
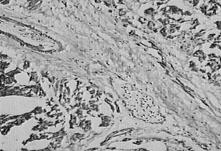
Согласно гистохимическим исследованиям, при оптимальной совокупности эффектов в области воздействия, обеспечиваемых мощными импульсами СО2-лазера, в ишемизированной зоне миокарда формируется сеть микрокапилляров (рис. 5). Как показывают результаты клинических применений, как в России, так и за рубежом, именно такой вид лазерного воздействия в настоящее время обеспечивает наилучший клинический эффект.
Рис. 5. Микрокапилляры в сердечной мышце (черные точки на срезе препарата) через 140 дней после перфорации.

Модель перфорации биоткани в режиме одиночного импульса.
В рамках модели послойного испарения биоткани рассмотрим возможности управления геометрией глубокого лазерного канала, основываясь на подходе [11]. Основное допущение состоит в приближении превалирования скорости испарения биоткани над скоростью отвода тепла из зоны взаимодействия излучения с материалом (кратера). Глубина каждого испаряемого слоя: 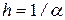 , где a - коэффициент поглощения излучения тканью, а h - характерная глубина проникновения излучения в материал.
, где a - коэффициент поглощения излучения тканью, а h - характерная глубина проникновения излучения в материал.
Испарительный режим имеет место при 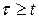 , где t - характерное время теплоотвода из нагреваемого объема, t - время, которое необходимо для излучения лазером энергии, равной энергии испарения вещества в нагреваемом объеме.
, где t - характерное время теплоотвода из нагреваемого объема, t - время, которое необходимо для излучения лазером энергии, равной энергии испарения вещества в нагреваемом объеме.
Из уравнения теплопроводности можно показать, что  , где
, где 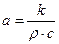 - коэффициент температуропроводности ткани (здесь k - теплопроводность, r - плотность, с - удельная теплоемкость).
- коэффициент температуропроводности ткани (здесь k - теплопроводность, r - плотность, с - удельная теплоемкость).
Учитывая, 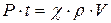 , где P=I·S - мощность лазерного излучения; I - интенсивность излучения, S - площадь поперечного сечения лазерного пучка;
, где P=I·S - мощность лазерного излучения; I - интенсивность излучения, S - площадь поперечного сечения лазерного пучка; 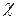 - удельная теплота испарения ткани; r - плотность ткани; V = h·S - нагреваемый излучением объем ткани, получаем условие реализации испарительного режима
- удельная теплота испарения ткани; r - плотность ткани; V = h·S - нагреваемый излучением объем ткани, получаем условие реализации испарительного режима 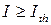 , где
, где 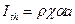 - пороговая интенсивность излучения, определяемая параметрами биоткани и длиной волны лазерного излучения.
- пороговая интенсивность излучения, определяемая параметрами биоткани и длиной волны лазерного излучения.
|
|
|
Уравнение динамики образования кратера в испарительном режиме имеет вид:
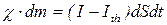 ,
,
или  . (1)
. (1)
Уравнение для скорости углубления кратера:
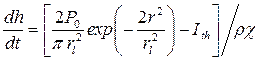 (2)
(2)
На основе данной модели проведен анализ основных закономерностей формирования глубоких лазерных каналов в водосодержащих мягких биотканях, к которым относится миокард. Параметры лазерного излучения, принятые при расчетах, соответствовали характеристикам лазерной системы «Перфокор».
Как видно на рис. 6а, расфокусировка лазерного пучка по мере удаления от фокальной плоскости приводит к уменьшению плотности мощности излучения и, соответственно, к уменьшению скорости испарения ткани, к прекращению ее перфорации и достижению конечной глубины канала. Использование известного технологического приема – заглубления фокальной плоскости относительно поверхности ткани - приводит к увеличению глубины канала на 5-10% (рис. 6б). При прочих равных условиях большая глубина канала и скорость перфорации будет наблюдаться при использовании длиннофокусных линз, что также дает возможность получения «кинжаловидного» профиля лазерного канала, когда диаметр входного отверстия меньше диаметра канала.
Рис. 6. Глубина канала в миокарде в зависимости от
а) длительности импульса. (эксперимент – сердце свиньи in vitro)
б) заглубления фокальной плоскости лазерного луча относительно поверхности биоткани.

а) б)
Принципиальной особенностью лазерной перфорации мягких биотканей является то, что канал не сохраняет свою форму, и с течением времени «закрывается». Что хорошо видно на экспериментах по перфорации биомоделей на основе желатина как имитатора водосодержащих биотканей (рис. 7).
Рис. 7. Лазерный канал в биомодели (80% воды и 20% желатина) после перфорации (а) и через 24 часа (б).
  а) а)
|  б) б)
|
Интеллектуальные кардиохирургические лазерные системы серии «Перфокор».
Возможность достижения необходимого эффекта воздействия зависит от энергетических параметров лазерного пучка, времени воздействия, теплофизических характеристик биоткани и ее объема, в котором поглощается энергия излучения. Объем ткани, в котором поглощается энергия лазерного излучения, определяется глубиной проникновения в ткань светового потока, что, в свою очередь, определяется длиной волны излучения.
Для проведения TMЛР в мировой клинической практике рассматривались возможности и эффективность различных лазерных систем, работающих как в режиме одиночного лазерного импульса, так и в импульсно-периодическом режиме с подводом излучения к операционному полю с помощью зеркально-шарнирного манипулятора или оптического волокна. Параметры лазерного излучения, условия проведения TMLR и характеристики формируемых каналов представлены в табл. 2.
Таблица 2. Параметры лазеров для TMLR и характеристики формируемого канала [12].
| Параметр | СО2 | Er:ИАГ | Но:ИАГ | Nd:ИАГ | XeCl |
| Длина волны | 10,6 | 2,94 | 2,08 | 1,44 | 0,308 |
| Длительность импульса | 50 мс | 800 мкс | 600 мкс | 500 мкс | 150 нс |
| Энергия в импульсе, Дж | 15-40 | 0,3 | 1-2 | 1-2 | 20-40 мДж |
| Частота, Гц | моноимпульс | 5-20 | 5-20 | ||
| Max скорость абляции на импульс, мм | 1,24 | 1,5 | |||
| Время создания канала | 50 мс | 4-8 с | 4-8 с | 3-6 с | |
| Подвод излучения | манипулятор | ZrF4 волокно | кварцевое волокно | ||
| Усилие для переме-щения волокна, г | - | ||||
| Диаметр канала, мм | ~1 | ~1 | ~1 | ~1 | 0,5-1 |
| Размер ЗТП, мкм | ³300 | 100-200 | ~300 | ~350 | ~50 |
| Давление ударной волны, МПа | ~3 | ~9 | ~10 | ~10 | ~500 |
| Геометрия канала | гладкий канал | канал с разрывами стенок |
Установки серии «Перфокор» для процедуры ТМЛР (рис.8) не имеет аналогов в России и Европе, а по некоторым показателям (энергетическая эффективность, весогабаритные характеристики, стоимость) превосходит единственные подобные системы “Heart Laser-1” и “Heart Laser-2” фирмы PLC Medical System, США [13-14].
Рис. 8. Модификации лазерных кардиохирургических систем серии «Перфокор» с 1996 г. по настоящее время.
 |
|
Таблица 3. Технические характеристики систем для ТМЛР отечественного и американского производства, разрешенных к применению в клинике.
| Наименование | «Heart Laser 1» PLC Medical System США | «Перфокор» ИПЛИТ РАН Россия | «Перфокор-М» ИПЛИТ РАН Россия |
| Длина волны излучения, мкм | 10,6 | 10,6 | 10,6 |
| Энергия в импульсе, Дж | 5-80 | 4-80 | 4-80 |
| Длительность импульса, мсек | 1-99 | 10-200 | 10-100 |
| Структура излучения | одномодовая + 30% др.мод | одномодовая чистая | одномодовая чистая |
| Средняя потребляемая мощность, кВт | 0,8 | ||
| Технический КПД, % | 11,5 | ||
| Расход газовой смеси, н. л./час | <1 | <1 | |
| Вес, кг | |||
| Манипулятор | семизеркальный «Laser Mech» | семизеркальный «Laser Mech» | семизеркальный отечественный |
| Система дистанцион-ного мониторинга | нет | нет | есть |
| Год начала выпуска |
Установки серии «Перфокор» оснащены автоматической системой управления работы установки, регистрации процесса операции, системой синхронизации излучения с ЭКГ пациента. Работы по созданию оборудования и внедрения в клиническую практику метода ТМЛР отмечены Премией Правительства РФ в области науки и техники за 2003 г.
В 2003 г. FDA (Food and Drug Administration) USA признала единственной безопасной системой для процедуры ТМЛР установки на базе мощных СО2-лазеров. Многолетняя практика применения процедуры TMLR в НЦССХ им. А.Н. Бакулева показала, что общая смертность составила: для СО2-лазера (7 лет наблюдений) – 4,9%, для XeCl-лазера (3 года наблюдений) – 17,8%, для волоконного лазера «Lason» (3 года наблюдений) – 20,8% [15].
Установки "Нeart Laser 1,2" США созданы на базе СО2-лазера с быстрой аксиальной прокачкой рабочей смеси и возбуждением высокочастотным разрядом. Такого типа лазеры выпускаются германской фирмой TRUMPF. В основу положена модель TLF 700 turbo.
Рис. 9. Клинические результаты ТМЛР. Динамика функционального класса стенокардии (а) и качество жизни по SF-36 (б) пациентов после ТМЛР с использованием различных типов лазеров (красная линия - СО2 лазер серии «Перфокор» (10,6 мкм), голубая – XeCl лазер(0,308), Nd:YAG (1,06), диодный (0,98).

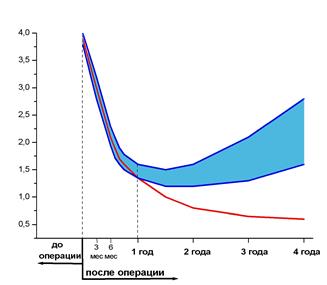
Общая летальность
(в сравнении с Европой и Америкой)
НЦССХ TLR.Int USA
им. А.Н.Бакулева Registry Trial
Интраоперационная 0,6% 6,7% -
Госпитальная 2,6% 9,7% 9%
Отдаленная 2,0% 3,6% 9%
Общая 4,6% 13,3% 18%
Смертность после процедуры ТМЛР.
• СО2 laser 9/600 1.5%
• XeCl laser 5/ 30 16.6%
• Low energy laser «LASON" 4/22 18.2%
Клинический опыт применения процедуры ТМЛР в России с использованием отечественной кардиохирургической установки «Перфокор» класса интеллектуальных медицинских систем продемонстрировал высокие результаты: процент смертности (менее 5%) рекордно низок по сравнению с зарубежными данными.
var swCatid=5273 Рис.10. Системы для ТМЛР производства США.
«Heart Laser 1» «Heart Laser 2»


Литература
1. Wearns J.T., Mettier S.R., Klump T.G., Zschiesche A.B. The nature of the vascular communications between the coronary arteries and the chambers of the heart // Am. Heart. J.,1933, Vol.9, рр. 143-170.
2. Mirhoseini M.M.D., Cayton M.M.. // J. Clinic. Laser Med. and Surg., 1997, 6, 245-253.
3. Mirhoseine M., Cayton M.M.Revascularization of the heart by laser // J. Microsc., 1981, Surg. v.2, pp. 253-260.
4. Скобелкин О.К., Бридикис Ю.Ю. и др. Реваскуляризация миокарда лазерным излучением Вестник хирургии, 1983, стр. 99-102.
5. Амбарцумян Р.В., Бредикис Ю.В., Брехов Е.И., Елисеенко В.И., Здрадовский С.Р., Корепанов В.И., Кошелев Е.П., Маркин Е.П., Обеленюс В.А., Попов Н.Н., Скобeлкин О.К., Чижов Г.К. Применение лазеров в кардиохирургии. // Электронная промышленность, 1984, 10(138), с.49-51.
6. Kathy Kinkade. Heart patients find new hope in transmyocardial revascularization. // Laser Focus World, 1998, vol.34, N.11, pp. 55-57
7. TMR Clinical Peport, Volume 5, 1998.
8. Gaughan R. Lasers make a comeback in treating heart disease. // Biophotonics International, July/August 2000, p. 48-53.
9. V.V.Vasiltsov, V.S.Golubev, E.N.Egorov, V.D.Dubrov, V.Ya.Panchenko et.al. High-power waveguide CO2 lasers for formation of deep channels in biological tissue, Proc. SPIE, v. 3264,
p.145-154, 1998.
10. Трансмиокардиальная лазерная реваскуляризация. Под ред. Л.А.Бокерия, И.И.Беришвили, Ю.И.Бузиашвили, И.Ю.Сигаева. –М.: Издательство НЦССХ им. А.Н. Бакулева, РАМН, 2001, -183 с.
11. Ivanenko M.M., Hering P., Klein M., Gams E.. Transmyocardial laser revascularization: are new approaches with new lasers possible. TMLR: Management of coronary artery Disease, 1997, Springer, p.p.153-164.
12. Беришвили И.И., Бокерия Л.А., Васильцов В.В., Панченко В.Я. и др.Мощный волноводный одномодовый СО2-лазер с диффузионным охлаждением для трансмиокардиальной реваскуляризации // Известия Академии Наук, серия физическая, 1999, т.63, N 10, стр. 2059-2065.
13. Панченко В.Я., Беришвили И.И., Васильцов В.В., Ульянов В.А. и др. Интеллектуальные лазерные медицинские системы для кардиохирургии и онкологии, Альманах клиническоймедицины N 12,  2006
2006  с. 125-128 2006
с. 125-128 2006
14. В.Панченко, В.Васильцов, В.Ульянов, Лазерный метод ТМЛР лечения ишемической болезни сердца, Фотоника N 1, стр.14-19.2012
15. В.Я. Панченко,И.И.Беришвили, В.В. Васильцов, В.А. Ульянов, Трансмиокардиальная лазерная реваскуляризация – новый высокотехнологичный метод лечения ишемической болезни сердца, Перспективные материалы, Спец. выпуск (14), февраль 2013 стр. 173-178.
16. Беришвили И.И., Артюхина Т.В.,Вахромеева М.Н., Ульянов В.А., Серов Р.А., Саррджвеладзе Э.Г., Семенов М.Х. Биофизика и гистопатология лазер-индуцированных повреждений миокарда при трансмиокардиальной лазерной реваскуляризации. Лазерная медицина, 2014, т. 18, вып. 3, с. 4-12.
17. В.В.Васильцов, В.Я.Панченко, В.А.Ульянов. Интеллектуальные лазерные системы для кардиохирургии серии «Перфокор». В коллективная монография «Современные лазерные и информационные технологии». Под ред. акад. В.Я.Панченко и проф. Ф.В.Лебедева. М., Интерконтакт Наука, 2015, с. 473 – 500.
|
|
|



