 |
В начальный момент времени концентрация пероксида водорода равна
|
|
|
|
Лабораторная работа №6 (выполняется в рамках УИРС)
Определение константы скорости каталитического разложения пероксида водорода
Цель работы: определить константу скорости реакции по экспериментально установленной зависимости концентрации вещества от времени.
Оборудование и реактивы: комнатный термометр, барометр, прибор для определения объема, выделившегося в ходе реакции кислорода (рисунок 7.1), воронка, секундомер, стакан на 100 мл, электроплитка, градуированная пробирка, фильтровальная бумага, 3%-ный раствор пероксида водорода, порошкообразный MnO2.
7.1 Теоретические пояснения
Реакция разложения пероксида водорода является последовательным процессом:
H2O2 = H2O + O
2O = O2
Можно ожидать, что в разбавленных растворах пероксида водорода его разложение определяется неустойчивостью самих молекул Н2О2, и первая стадия является лимитирующей. Поэтому скорость разложения пероксида водорода должна описываться кинетическим уравнением для реакций первого порядка:
v = k  , (7.1)
, (7.1)
где k – константа скорости реакции.
Она остается постоянной величиной при сохранении неизменными условий опыта.
Скорость разложения пероксида водорода при обычных условиях невелика, поэтому процесс проводится в присутствии катализатора. Ускоряют разложение H2O2 многие вещества: стекло, платина, уголь, соли и оксиды ряда металлов, в том числе и диоксид марганца.
Для реакции первого порядка можно записать:
v 
 . (7.2)
. (7.2)
Разделим переменные:
d  /
/  = - k×dt,
= - k×dt,
проинтегрируем:
 d
d  /
/  = -
= -  k×dt,
k×dt,
lnC = -kt + B, (7.3)
где В – постоянная интегрирования;
С – концентрация Н2О2.
В начальный момент времени t=0, С=С0. Подставляя эти значения в уравнение (7.3), получим
|
|
|
lnC0=B. (7.4)
Подставим условие (7.4) в выражение (7.3):
lnC= - kt + lnC0.
После несложных преобразований приходим к выражениям:
lnC0/C = kt (7.5)
или
2,3lgC0/C = kt (7.6)
Уравнения (7.5) и (7.6) выражают зависимость концентрации от времени для реакции первого порядка.
В настоящей работе концентрация пероксида водорода определяется по объему выделившегося кислорода. В соответствии со стехиометрией реакции
Н2О2 = Н2О + ½ О2,
зная полный объем выделившегося кислорода, можно рассчитать начальное количество вещества пероксида водорода по уравнению
 ,
,
где V0(O2) – объем кислорода при нормальных условиях, соответствующий полному разложению пероксида водорода, мл.
По аналогичному выражению можно рассчитать количество вещества пероксида водорода, распавшегося к моменту времени t:
 ,
,
где  – объем кислорода при нормальных условиях, выделившийся к моменту времени t, мл.
– объем кислорода при нормальных условиях, выделившийся к моменту времени t, мл.
В начальный момент времени концентрация пероксида водорода равна
 ,
,
где V – объем реакционной смеси.
Концентрация пероксида водорода к моменту времени t:
 . (7.7)
. (7.7)
Подставляя выражения для С и С0 в уравнение (7.6), получаем:

(7.8)
Выражение (7.8) является расчетной формулой в настоящей лабораторной работе.
7.2 Методика проведения опыта
7.2.1 Для определения объема выделившегося кислорода собрать прибор по рисунку 7.1. Перед началом опыта проверить прибор на герметичность. Для этого налить в бюретку воду, которая должна заполнить также и резиновую трубку, соединяющую бюретку с воронкой. Затем присоединить пробирку к прибору и отметить уровень воды в бюретке. Подняв кольцо штатива, переместить воронку вверх. При этом в приборе создается давление, превышающее атмосферное. Закрепить воронку в этом положении и в течение 1 – 2 минут наблюдать за уровнем воды в бюретке. Если уровень не изменился после первоначального небольшого повышения, то прибор герметичен. Если же уровень воды в бюретке повышается непрерывно, то герметичность нарушена, и следует исправить дефекты, допущенные при сборке прибора.
|
|
|
7.2.2 Вынуть пробку из пробирки и передвижением воронки установить уровень воды в бюретке на нулевом делении или немного ниже.
7.2.3 Отмерить 3 мл 3% раствора пероксида водорода и влить в пробирку через воронку.

Рисунок 7.1 – Прибор для определения объема выделившегося кислорода:
1 – бюретка, 2 – воронка, 3 – пробирка.
7.2.4 Держа пробирку в наклоненном положении, положить на ее сухую стенку фильтровальную бумажку, в которую завернут оксид марганца (IV), количеством со спичечную головку. Присоединить пробирку к прибору, плотно закрыв ее пробкой. Держа пробирку наклонно, снова проверить прибор на герметичность.
7.2.5 Передвижением воронки привести воду в бюретке и воронке к одному уровню. Отметить и записать уровень воды в бюретке, произведя отсчет по нижнему краю мениска с точностью 0,1 мл.
7.2.6 Стряхнуть катализатор в раствор пероксида водорода. Кислород, выделяющийся при его разложении, вытесняет из бюретки воду. Воронку во время опыта нужно опускать, чтобы во время опыта вода в ней и в бюретке находилась на одинаковом уровне. Тогда давление газа в приборе все время будет близко к атмосферному. Первые 10 минут необходимо записывать уровень воды в бюретке каждые 2 минуты, следующие 15 минут – каждые 5 минут. К концу опыта реакция сильно замедляется. Поэтому для определения объема газа, выделившегося при практически полном разложении пероксида водорода, нужно погрузить пробирку в стакан с горячей (80 – 900С) водой. Спустя 10 минут дать прибору остыть и, приведя давление в нем к атмосферному, записать объем всего выделившегося кислорода.
7.2.7 Результаты опыта занести в таблицу 7.1.
Таблица 7.1 – Результаты опыта
| Время t, мин | ¼ | |||||
| Объем О2 в бюретке, мл | V(O2)нач | V(O2)2-V(O2)нач | V(O2)4-V(O2)нач | ¼ | V(O2)25-V(O2)нач | V(O2)=V(O2)кон- -V(O2)нач |
| Объем О2, приведен-ный к н.у., мл |
Температура опыта Т = ¼ Атмосферное давление Р = ¼
7.3 Обработка результатов опыта
7.3.1 Привести все объемы выделившегося кислорода к нормальным условиям (Р0=760 мм рт.ст.; Т0=273 К), используя объединенное уравнение газового состояния:
|
|
|
 ;
;
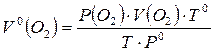
7.3.2 Так как кислород собирается над водой, то он насыщен водяным паром. Общее давление в приборе равно атмосферному Р и складывается из парциального давления кислорода Р(О2) и парциального давления водяного пара h. Р(О2)=Р – h.
Для нахождения значения давления насыщенного водяного пара h при температуре опыта следует воспользоваться таблицей 7.2.
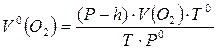
Записать полученные значения V0(O2) в таблицу 7.1.
Таблица 7.2 – Давление насыщенного водяного пара h при различных температурах
| t, 0C | h, мм рт.ст. | t, 0C | h, мм рт.ст. | t, 0C | h, мм рт.ст. | t, 0С | h, мм рт.ст. |
| 9,2 | 12.8 | 17,5 | 23.8 | ||||
| 9,6 | 13.6 | 18.6 | 25,5 | ||||
| 10,5 | 14.5 | 19.8 | 26,7 | ||||
| 11,2 | 15,5 | 21,1 | 28,3 | ||||
| 12,0 | 16,5 | 22.4 | 30.0 |
7.3.3 Построить график зависимости объема выделившегося кислорода V0(O2) от времени t, откладывая по оси абсцисс время в минутах, а по оси
ординат – объем кислорода в мл.
7.3.4 Выберите на полученной кривой три точки и рассчитайте для них константу скорости в соответствии с выражением (7.8). Если значения константы остаются практически постоянными, то изучаемая реакция действительно является реакцией первого порядка.
7.3.5 Константу скорости можно также определить графически. Для этого нужно построить график зависимости lnС от времени (концентрацию пероксида водорода С можно рассчитать по выражению (7.7). Этот график для реакции первого порядка должен представлять собой прямую линию, причем константа скорости реакции k численно равняется тангенсу угла наклона b прямой к оси абсцисс.
b=1800 - a
tgb=tg(1800 - a)= - tga
Тангенс угла a, в соответствии с рисунком 7.2,находится как отношение величин а/в противолежащего катета к прилежащему, выраженных в единицах выбранного масштаба.
 lnC
lnC
 |
а
b

 a
a
 в t
в t
Рисунок 7.2 – Зависимость lnC от времени
7.3.6 Определить размерность константы скорости первого порядка
|
|
|


