 |
6. Оснащение рабочего места. 7. Содержание занятия. 7.1. Образец билета входного контроля. 7.3. Самостоятельная работа обучающихся
|
|
|
|
6. Оснащение рабочего места.
6. 1. Дидактический материал: справочник физико-химических величин,
6. 2. ТСО: калькуляторы.
6. 3. Посуда и приборы: Калориметр, термометр, 2 мерных цилиндра (на группу)
6. 4. Объекты исследования: раствор 1н. Н2SO4 (на группу)
6. 5. Реактивы: раствор 1н. КОН (на группу)
7. Содержание занятия
7. 1. Образец билета входного контроля
1. Закрытой называется система, если:
а) Dm=0; DE¹ 0 б) Dm=0; DE=0 в) Dm¹ 0; DE¹ 0; г) Dm¹ 0; DE=0
2. Математическое выражение I начала термодинамики:
а) G=H-T× S б) 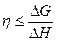
в) Q=DU+A г) D 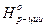 =Sm× D
=Sm× D 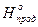 - Sm× D
- Sm× D 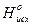
3. Экзергоническими называются реакции, если:
а) DН< 0 б) DS> 0 в) DG< 0;
г) DН> 0 д) DS< 0 е) DG> 0
4. Условием самопроизвольного протекания реакции в изолированной системе является:
а) DG< 0 б) DS=0 в) DG=0;
г) DS> 0 д) DS< 0 е) DG> 0
5. При стандартных условиях данный процесс возможен CuO+H2=H2O+Cu, т. к.:
а) DН> 0; DS> 0 б) DH< 0; DS> 0 в) DH< 0; DS< 0 г) DH> 0; DS< 0
7. 2. Узловые вопросы, необходимые для усвоения темы занятия:
1. Основные понятия химической термодинамики. Классификация систем и процессов, примеры.
2. Тепловой эффект процесса. Энтальпия. Экзотермические, эндотермические процессы. Закон Гесса, следствия из него. Термохимические расчеты.
3. Энтропия, ее смысл, изменения в различных процессах, расчет.
|
|
|
4. Энергия Гиббса, ее смысл, расчет.
7. 3. Самостоятельная работа обучающихся
7. 3. 1. Лабораторная работа.
Задание. Определение теплоты реакции нейтрализации.
2 NaOH +H2SO4 = Na2SO4 + 2 H2O ∆ Нонейтр. =?
Во взвешенный калориметрический стакан налейте30 мл 1н. раствора щелочи NaOH, измерьте термометром температуру раствора до реакции t1.
В другой цилиндр налейте 30 мл 1н. раствора H2SO4. Быстро влейте раствор кислоты вкалориметр к раствору щелочи, осторожно перемешайте раствор и отметьте самую высокую температуру раствора t2. Приняв теплоемкость раствора Ср = 4, 18 Дж/г∙ град, стеклаСс = 0, 75 Дж/г∙ град, зная массы раствора (60г) и калориметрического стакана, вычислите количествотеплоты, выделившейся в результате реакции (∆ Н), теплоту нейтрализации (∆ Ннейтр. ). Определите абсолютную и относительную ошибки опыта.
Справочная ∆ Ннейтр. = - 57, 2 кДж/моль.
Результаты опыта занесите в таблицу.
| № | Величина | Обозначение, ед. изм. | Значение |
| Масса калориметрического стакана | mc, г | ||
| Начальная температура | t1, oC | ||
| Конечная температура | t2, oC | ||
| Теплоемкость системы | ∑ С=Срmp+Ccmc, Дж/г | ||
| Количество выделившейся теплоты | ∆ Н=-∑ С∙ ( t2- t1), Дж | ||
| Теплота нейтрализации | ∆ Ннейтр=∆ Н/0, 03, дЖ/моль | ||
| Абсолютная погрешность опыта | δ =∆ Нн. теор-∆ Нн. . эксп | ||
| Относительная погрешность опыта | ∆ =│ δ: ∆ Ннейтр│ ∙ 100% |
7. 3. 2. Задачи для самостоятельной работы.
1. Разбор типовых задач.
1. Вычислить стандартную теплоту реакции: 2СО(г)+ SO2(г)®S(тв)+ 2СО2(г). Решение: Из следствия закона Гесса имеем:
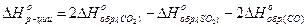 ;
; 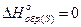
Из справочника находим стандартные энтальпии образования и подставляем их в уравнение:
|
|
|
 = -269, 1 кДж/моль
= -269, 1 кДж/моль
2. Для реакции N2 + O2« 2NO рассчитайте изменение энергии Гиббса при стандартных условиях и оцените вклад энтальпийного и энтропийного факторов в самопроизвольное течение реакции, еслиDНо = +182 кДж/моль; DSо = +25  .
.
Решение: Согласно уравнению DGo = DHo - TDSo
имеем: DGo = 182 кДж/моль – 298о К × 0, 025  = 174, 6 кДж/моль
= 174, 6 кДж/моль
Следовательно, при стандартных условиях реакция самопроизвольно протекать не может. Но если учесть, что условием самопроизвольного процесса является DGo< 0, то DHo - TDSo< 0 или DHo< TDSo.
Так как DНº > 0, то тепло поглощается, поэтому энтальпийный фактор неблагоприятный. DSº > 0, это означает, что энтропийный фактор благоприятен.
Такие процессы самопроизвольно протекают при высоких температурах.
|
|
|


