 |
Определение z* и расчет МЭ простых и сложных веществ
|
|
|
|
Определение z* и расчет МЭ простых и сложных веществ
| Тип реакции | Вещество | Определение числа эквивалентности z* | Формула для расчета МЭ | Пример |
| Не участвует в реакции | Оксид | 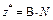 , где
В – валентность элемента; N – число атомов элемента , где
В – валентность элемента; N – число атомов элемента
| 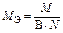
| Na2O: 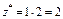 , ,
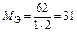 г/моль г/моль
|
| Соль | 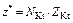 , где , где 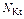 – число катионов; – число катионов; 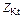 – заряд катиона – заряд катиона
| 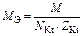
| AlCl3:  , ,
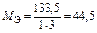 г/моль г/моль
| |
| Основание | 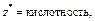 т. е. число ионов OH–, способных замещаться на анионы т. е. число ионов OH–, способных замещаться на анионы
| 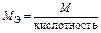
| Ca(OH)2: 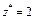 , ,
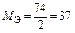 г/моль г/моль
| |
| Кислота |  то есть число ионов H+, способных замещаться на катионы
то есть число ионов H+, способных замещаться на катионы
| 
| H2SO4: 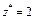 , ,
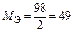 г/моль г/моль
| |
| Ионного обмена | Любое | 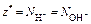 ,
где ,
где 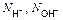 - число ионов Н+ или ОН–, переходящих от одного вещества к другому - число ионов Н+ или ОН–, переходящих от одного вещества к другому
| 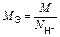 или
или
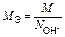
| Al(OH)3 + 2HCl = = Al(OH)Cl2 + 2H2O
Для Al(OH)3: 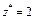 , , 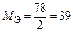 г/моль г/моль
|
Продолжение табл. 1
| Тип реакции | Вещество | Определение числа эквивалентности z* | Формула для расчета МЭ | Пример |
| ОВР | Любое | 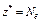 ,
где Ne – число электронов, принятых (или отданных) окислителем (или восстановителем) ,
где Ne – число электронов, принятых (или отданных) окислителем (или восстановителем)
| 
| 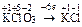 Для KClO3:
Для KClO3: 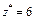 , , 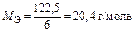
|
Закон эквивалентов: массы реагирующих друг с другом веществ, а также массы образовавшихся продуктов пропорциональны молярным массам эквивалентов этих веществ.
Математически закон эквивалентов для условной реакции вида
А + В ® С + D
можно выразить различными способами. Например:
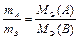 или
или 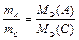 . (13)
. (13)
Если в реакции участвуют газообразные вещества, то закон эквивалентов целесообразнее записать как соотношение объемов
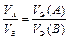 . (13а)
. (13а)
Наконец, когда один из участников реакции – газ, а другой – твердый реагент, то формула, выражающая закон эквивалентов, принимает вид
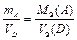 . (13б)
. (13б)
|
|
|
Примеры решения задач
Пример 1. Определите, сколько молекул СО образуется при сгорании 4 мг углерода. Чему равна абсолютная масса одной молекулы кислорода?
Р е ш е н и е
Составим уравнение реакции горения углерода с образованием СО:
2С + О2 = 2СО,
из которого следует, что при сгорании 2 моль углерода образует
ся 2 моль газа СО. Используем формулу (2) для определения количества моль углерода, которое будет равно числу моль СО:
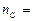
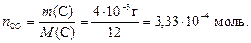
Тогда число молекул оксида углерода (II) найдем по формуле (1):
 NСО = nCO × NA = 3, 33 × 10-4 × 6, 02 × 1023 = 2, 00 × 1020.
NСО = nCO × NA = 3, 33 × 10-4 × 6, 02 × 1023 = 2, 00 × 1020.
Рассчитаем относительную молекулярную массу молекулы O2
Mr = 2× Ar(O) = 2× 16 = 32 а. е. м.
Так как Mr и масса 1 моль вещества численно равны друг
другу, то
 .
.
Ответ: NСО = 2× 1020; 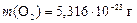 .
.
Пример 2. Сколько моль атомов азота содержится в 1 кг нитрата аммония? Определите массовую долю азота в данной соли.
Р е ш е н и е
Определяем молярную массу нитрата аммония NH4NO3:
М = 2 Ar(N) + 4 Ar(H) + 3 Ar(O) = 2 × 14 + 4 × 1 + 3 × 16 =
= 80 г/моль.
Из формулы вещества NH4NO3 следует, что 1 моль нитрата аммония содержит 2 моль атомов азота, тогда
n(N) = 2 × nнитрата = 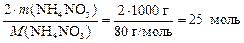 .
.
Массовую долю азота найдем как отношение двух Аr(N) к молярной массе NH4NO3:
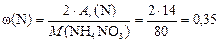 или 35 % мас.
или 35 % мас.
Ответ: число моль атомов азота равно 25 моль; w (N) = = 35 % мас.
Пример 3. Выразите в молях и в граммах 6, 02 × 1021 молекул СО2.
Р е ш е н и е
Находим число моль молекул СО2:
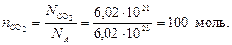
Определяем массу 100 моль молекул диоксида углерода
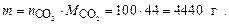
Ответ: nСО2 = 100 моль; масса CO2 равна 4400 г.
Пример 4. Массовая доля фосфора в его оксиде равна 43, 7 % мас. Установите простейшую формулу оксида.
Р е ш е н и е
Обозначим числа атомов фосфора и кислорода в простейшей формуле оксида через х и у. Аr данных элементов равны 31 и 16. Значит, массы фосфора и кислорода в составе оксида относятся друг к другу как 31х : 16у. По условию задачи в 100 г оксида содержится 43, 7 г фосфора и (100 – 43, 7) = 56, 3 г кислорода. Следовательно,
|
|
|
31х : 16у = 43, 7: 56, 3 или х: у = 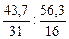 = 1, 41: 3, 52.
= 1, 41: 3, 52.
Чтобы выразить полученное соотношение целыми числами, необходимо оба значения поделить на наименьшее из них:
х: у = 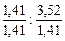 = 1: 2, 5.
= 1: 2, 5.
Поскольку дробные коэффициенты в химических формулах не употребляются, то оба члена последнего соотношения умножим на два
х: у = 2: 5.
Ответ: простейшая формула оксида фосфора Р2О5.
Пример 5. Вычислите относительную плотность пропана по водороду и по воздуху.
Р е ш е н и е
Используем второе следствие закона Авогадро. Тогда по формуле (4) плотности пропана (С3Н8) по водороду (Н2) и воздуху соответственно равны:
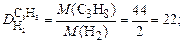
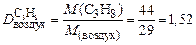 .
.
Ответ: 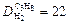 ;
; 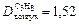 .
.
Пример 6. При температуре 280 К в сосуде вместимостью 14 дм3 находится 8 г водорода и 0, 25 моль азота. Определите общее давление в системе и парциальные давления каждого газа. Вычислите мольные, объемные и массовые доли компонентов в имеющейся смеси.
Р е ш е н и е
По формуле (2) находим число моль водорода в смеси:
 .
.
По формуле (7) рассчитываем парциальные давления газов:
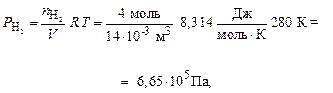
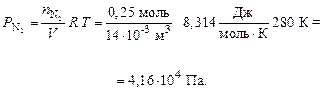
Общее давление смеси находим по формуле (6):
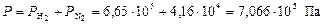 .
.
Рассчитываем массовые доли компонентов:
 ;
;
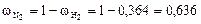 .
.
Вычисляем мольные доли газов в смеси:
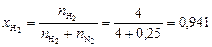 ;
;
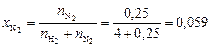 .
.
Для оценки объемных долей газов находим объемы H2 и N2 по формуле (5):
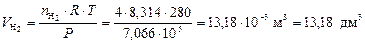 ;
;
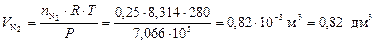 .
.
Тогда объемные доли водорода и азота соответственно равны:
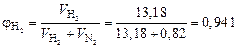 ;
;
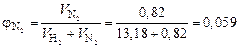 .
.
Таким образом, численные значения объемной и мольной доли для газов совпадают, так как выполняется закон Авогадро.
Ответ: 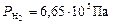 ;
; 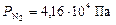 ;
; 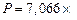
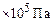 ;
; 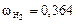 ;
; 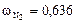 ;
; 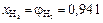 ;
; 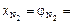
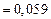 .
.
Пример 7. Какой объем займет смесь газов, содержащая 14 г азота, 32 г кислорода и 35, 5 г хлора, при нормальных условиях и в условиях, когда температура возрастет на 20 К, а давление – на 0, 5 атм?
Р е ш е н и е
Определяем общее число моль газов в смеси:
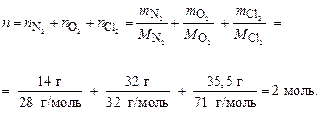
По первому следствию закона Авогадро объем смеси газов при н. у. равен
V° = n× V  = 2 × 22, 4 = 44, 8 дм3.
= 2 × 22, 4 = 44, 8 дм3.
Определяем температуру и давление в новых условиях
Т = 273 + 20 = 293 К;
|
|
|
Р = 1 + 0, 5 = 1, 5 атм = 1, 5 × 101 325 = 151 987, 5 Па.
Тогда по формуле (5) находим объем газовой смеси:
V = 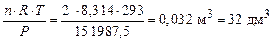 .
.
Ответ: V° = 44, 8 дм3; V = 32 дм3.
Пример 8. Вычислите МЭ элементов в соединении CS2 и молярные эквивалентные массы веществ Al и SO3.
Р е ш е н и е
Находим с. о. элементов в сероуглероде 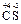 2. Тогда по формуле (9)
2. Тогда по формуле (9)
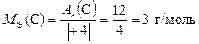 ,
,
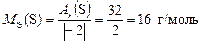 .
.
Алюминий в соединениях проявляет постоянную валентность В = 3, тогда по формуле (10)
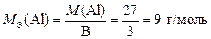 .
.
Валентность серы в оксиде SO3 равна В = 6, а число атомов S равно N = 1, тогда
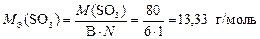 .
.
Ответ: 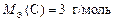 ;
; 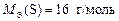 ;
; 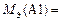
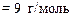 ;
; 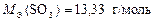 .
.
Пример 9. Определите МЭ ортофосфорной кислоты и гидроксида марганца, участвующих в реакциях:
1) Н3PO4 + 2KOH = K2HPO4 + 2H2O;
2) Mn(OH)2 + Cl2 + 2KOH = MnO2 + 2KCl + 2H2O.
Р е ш е н и е
Реакция 1) является ионно-обменной, так как протекает без изменения с. о. элементов. В данном случае от 1 моль Н3PO4 к молекулам KOH переходит два иона Н+, т. е. 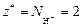 . Тогда
. Тогда
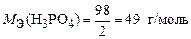 .
.
Реакция 2) – это окислительно-восстановительный процесс. В гидроксиде с. о. атома Mn равна +2, а в продукте реакции она составляет +4. Атом марганца теряет два электрона в процессе окисления, тогда 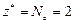 , а
, а
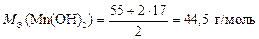 .
.
Ответ: 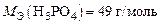 ;
; 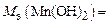
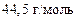 .
.
Пример 10. Вычислите молярный эквивалентный объем О2 и Н2 при н. у.
Р е ш е н и е
Э(Н) = 1 по определению. Чаще всего с. о. кислорода в сложном веществе равна –2, поэтому Э(О) = 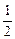 . Газы Н2 и О2 состоят из двух атомов, тогда по формуле (11)
. Газы Н2 и О2 состоят из двух атомов, тогда по формуле (11)
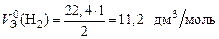 ;
;
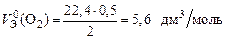 .
.
Ответ: 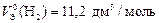 ;
; 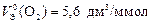 ь.
ь.
Пример 11. При сгорании 5 г металла образуется 9, 44 г оксида металла. Вычислите молярную эквивалентную массу металла. Определите относительную атомную массу металла, если его валентность в оксиде равна В = 3.
|
|
|


