 |
Примеры решения задач. Р е ш е н и е. По формуле (15) найдем энергию образования 1 моль молекул аммиака . По рис. 1 определяем СИ связи. СИ » 5 %. Тогда
|
|
|
|
Примеры решения задач
Пример 1. Средняя энергия связи N–Н в молекуле NH3 равна 385 кДж/моль. Какое количество энергии необходимо затратить, чтобы разложить на атомы: а) 1 молекулу аммиака; б) 10 г аммиака?
Р е ш е н и е
По формуле (15) найдем энергию образования 1 моль молекул аммиака
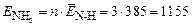
 кДж/моль.
кДж/моль.
Тогда на разрушение 1 молекулы аммиака понадобится энергия
 Дж.
Дж.
Энергия, необходимая для разложения 10 г аммиака, составляет
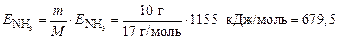
 кДж.
кДж.
Пример 2. Укажите механизм образования связей, направление смещения общих электронных пар и способ перекрывания АО в ионе SiF  . Установите тип гибридизации центрального атома, форму и полярность молекулы.
. Установите тип гибридизации центрального атома, форму и полярность молекулы.
Р е ш е н и е
Ион SiF  может быть получен при взаимодействии двух ионов F– c молекулой SiF4. Запишем электронные формулы валентных подуровней взаимодействующих атомов и ионов:
может быть получен при взаимодействии двух ионов F– c молекулой SiF4. Запишем электронные формулы валентных подуровней взаимодействующих атомов и ионов:
Si: …3s2 3p2 3d 0 F: …2s2 2p5 F– : …2s2 2p6
В основном состоянии атом кремния имеет 2 непарных электрона на 3p подуровне, атом фтора – 1 непарный электрон на 2р подуровне, а ион фтора не имеет непарных электронов. Для образования четырех связей с четырьмя атомами фтора по обменному механизму атому кремния необходимо иметь четыре одноэлектронных АО, поэтому он перейдет в возбужденное состояние
Si + E ® Si*: … 3s1 3p 3.
Свободные АО 3d-подуровня со стороны Si участвуют в образовании двух связей с ионами F– по донорно-акцепторному механизму, где кремний выполняет роль акцептора, а ионы фтора являются донорами. Таким образом, в частице SiF 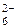 четыре связи образованы по обменному механизму, а две - по донорно-акцепторному.
четыре связи образованы по обменному механизму, а две - по донорно-акцепторному.
По табл. 4 находим ЭО(Si) = 1, 74 и ЭО(F) = 4, 00. ЭО(F) >
|
|
|
> ЭО(Si), значит, смещение общих электронных пар происходит к атомам F.
Так как все связи в ионе SiF 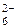 являются одинарными, то по способу перекрывания АО все они являются s-связями.
являются одинарными, то по способу перекрывания АО все они являются s-связями.
Тип гибридизации определяем по числу АО кремния, которые участвовали в образовании связей независимо от механизма их возникновения. Со стороны атома Si связи образованы с участием одной s-, трех p- и двух d-АО, следовательно, тип гибридизации – sp3d 2. Геометрическая форма – октаэдр (см. табл. 5), так как все гибридные АО являются связывающими (количество Ё = 0). Согласно табл. 6, определяем, что частица SiF 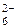 – неполярная, т. е.
– неполярная, т. е. 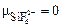 .
.
Пример 3. ЭМД молекулы IСl равен 0, 54 D. Определите степень ковалентности связи и длину диполя молекулы.
Р е ш е н и е
Согласно табл. 4, ЭО атомов хлора и йода соответственно равны 2, 83 и 2, 21. Находим разность ЭО атомов:
DЭО(Cl – I) = 2, 83 – 2, 21 = 0, 62.
По рис. 1 определяем СИ связи. СИ » 5 %. Тогда
СК = 100 – 5 = 95 %.
По формуле (17) вычисляем эффективные заряды атомов
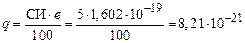 Кл.
Кл.
В молекуле IСl присутствует только одна связь I – Cl, поэтому ЭМД молекулы и ЭДМ связи совпадают. По формуле (16) оцениваем длину диполя
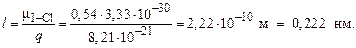
Пример 4. Составьте энергетическую диаграмму МО молекулы C2 и определите порядок связи в частице. Каковы ее магнитные свойства?
Р е ш е н и е
Образование химической связи в молекуле C2 может быть представлено следующим образом:
2C: 1s 2 2s 2 2p 5 →
→ C2 
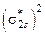
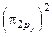
 .
.
Строим энергетическую диаграмму молекулы (рис. 4), из которой следует, что молекула С2 - диамагнитная (все электроны – спаренные).
Порядок связи оцениваем по формуле (18):
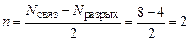 .
.

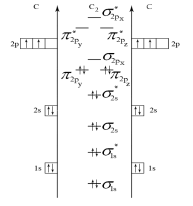
Рис. 4. Энергетическая диаграмма молекулы С2 по ММО
Пример 5. Составьте энергетические диаграммы МО для частиц СN– и NО. Определите магнитные свойства каждой частицы. Какая из них более прочная и почему?
|
|
|
Р е ш е н и е
Ион СN– состоит из атома углерода и иона N–. Электроны в этих частицах распределяются по АО следующим образом:
С: 1s2 2s2 2p2 N–: 1s2 2s2 2p4.
Для распределения электронов по МО необходимо сравнить ЭО атомов. Из табл. 4 выбираем ЭО(С) = 2, 5 и ЭО(N) = 3. Поскольку ЭО(С) < ЭО(N), энергия исходных АО иона N– будет меньше, чем у атома углерода. Строим энергетическую диаграмму (см. рис. 5, а). Определяем порядок связи:
n = (10 – 4) /2 = 3.
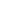
p*2py
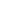
p2py
s*2s
p2pz
s2px
p2py
2p
2s
1s
1s
2s
p*2pz
s*1s
s1s
s*2px
s2s
2p
p*2pz
2p
2p
2s
1s
1s
2s
p*2py
p2pz
s*1s
s*2s
s1s
s2px
s*2px
s2s
|
|
|


