 |
Алифатические гидроксокислоты.Номенклатура и изомерия
|
|
|
|
В названиях алифатических гидроксикислот по заместительной номенклатуре гидроксильная группа отражается префиксом гидрокси- с указанием цифрой ее положения в главной углеродной цепи, карбоксильная группа – суффиксом –овая кислота, так как она является старшей характеристической группой. При наличии двух и более одноименных функциональных групп соответственно перед префиксом и суффиксом ставятся умножительные приставки ди-, три-, т. д. Для природных гидроксикислот используются прочно укоренившиеся тривиальные названия, например, молочная, винная, лимонная кислота.

Структурная изомерия алифатических гидроксикарбоновых кислот обусловлена взаимным расположением карбоксильной и гидроксильной групп. По этому признаку различают γ, β, α – гидроксикислоты и т. д.
№46.Химичсекие свойства гидроксикислот как бифунциональных соединений. Отношение к нагреванию
Химические свойства
Алифатические гидроксикарбоновые кислоты проявляют свойства, характерные как для карбоновых кислот, так и для спиртов. Кроме того, у них появляется ряд специфических свойств.
I.Реакции карбоксильной группы.
1. При взаимодействии со щелочами гидроксикарбоновые кислоты образуют соли.
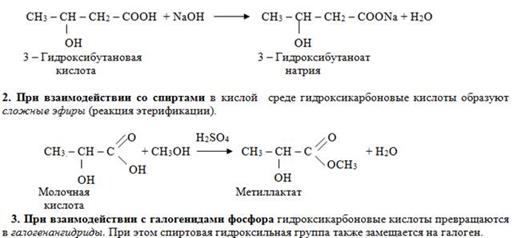
ΙΙ. Реакции гидроксильной группы

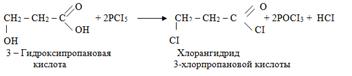
2. При взаимодействии с галогеноводородами (HCI, HBr) происходит нуклеофильное замещение спиртовой
гидроксильной группы на галоген и получаются галогенозамещенные кислоты. Так как карбоксильная группа в этих условиях не реагирует с галогеноводородами, то галогенангидрид в этой реакции не образуется:

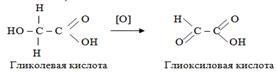
3. При окислении гидроксикислот получаются оксокарбоновые кислоты (альдегидо- и кетонокислоты).
|
|
|
ТЕОРЕТИЧЕСКИЕ ВОПРОСЫ К ПРОМЕЖУТОЧНОМУ ЭКЗАМЕНУ ПО ОРГАНИЧЕСКОЙ ХИМИИ
48.Фенолокислоты. Кислотность, химические свойства карбоксильной группы, реакции фенольного гидроксила, декарбоксилирования. Качественные реакции.
.Фенолокислотами – называют производные ароматических углеводородов, которые можно получить из них в результате замены атомов H карбоксильной и гидроксильной группами, причем OH группы замещают атомы H в бензольном кольце.
Изомерия фенолокислот обусловлена взаимным расположением OH и COOH групп в бензольном кольце.
В названиях фенолокислот по заместительной номенклатуре за родоначальную структуру правилами ИЮПАК принята бензойная кислота, наличие OH группы отражается префиксом гидроокси-

2 – гидроокси 3 – гидроокси 4 – гидроокси 3,4,5 – тригидро
бензойная кислота бензойная кислота бензойная кислота оксибензойная
кислота
Для многих фенолокислот употребляют названия салициловая, галловая и др.
.Способы получения
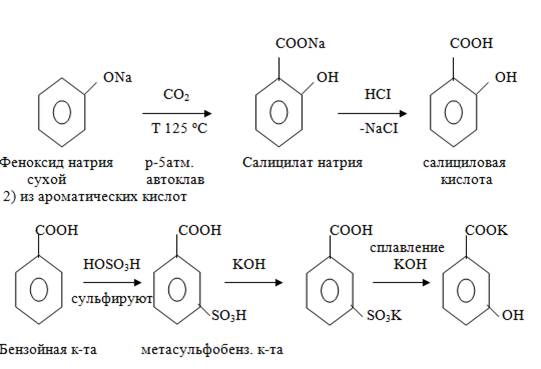
В природных условиях многие фенолокислоты содержатся в растениях в свободном состоянии или в виде сложных эфиров.
Синтетические способы
Чаще всего получают прямым карбоксилированием фенолов, т. е. непосредственным введением карбоксильной группы.
.Химические свойства
Фенолокислоты представляют собой твердые кристаллические вещества. Фенолокислоты с одним фенольным OH плохо растворимы в воде, с увеличением числа фенольных OH растворимость повышается.
Химические свойства фенолокислот являются сочетанием свойств ароматических кислот, фенолов и углеводородных R. Фенолокислоты обладают кислотными свойствами, обусловленными наличием как COOH, так и OH.
Кислотные свойства
Салициловая кислота обладает более сильными кислотными свойствами, чем ее мета и пара – изомеры. Повышенная кислотность объясняется тем, что ее анион дополнительно стабилизируется внутримолекулярной водородной связью, образованной за счет орто положения функциональныхгрупп. 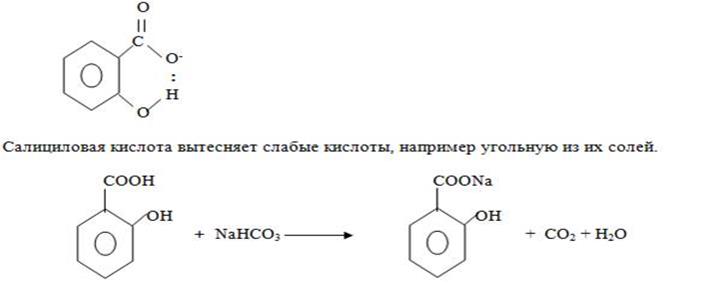
|
|
|
(Фенольный OH неспособен вытеснять, более слабая кислота, чем угольная, поэтому остается свободным.)
При взаимодействии салициловой кислоты с 2 моль сильного основания образуются соли как по карбоксильной группе так и при участии
фенольного OH (более слабый кислотныйцентр) 
Фенолы не вступают в реакцию этерификации из за низкой нуклеофильности.
Фенилсалицилат (салол) – эфир салициловой кислоты получают при взаимодействии салициловой кислоты, фенола, фосфорил хлорида.

Реакции фенольной гидроксильной группы.
Салициловая кислота за счет OH способна образовывать эфиры простые и сложные.

Способна гидролизироваться в кислой и щелочной средах. Следует учитывать при хранении, не должно быть контакта с влагой.

Качественной реакцией на салициловую кислоту является реакция с FeCI3 образуется фиолетовое окрашивание, ацетилсалициловая кислота этой реакции не дает. Это различие используется при определении доброкачественности ацетилсалициловой кислоты.
ДЕКАРБОКСИЛИРОВАНИЕ
Салициловая кислота при осторожном нагревании возгоняется и образует красивые игольчатые кристаллы, при сильном нагревании происходит декарбоксилирование.

49.Силициловая кислота. Эфиры салициловой кислоты: ацетилсалициловая кислота, фенилсалицилат. Применение в медицине.
50.Аминокислоты. Классификация. Номенклатура. Строение. Медико-биологическое значение: ГАМК, ПАБК и её эфиры.Анестезин, новокаин. Применение в медицине, фармации.
.Аминокислоты – это производные углеводородов, содержащие аминогруппы

Их можно рассматривать как производные карбоновых кислот, у которых один или несколько атомов водорода замещены аминогруппами.
Общая формула: (NH2)mR(COOH)n, где m или n чаще равны 1 или 2. Таким образом, аминокислоты являются соединениями со смешанными функциями.
Названия аминокислотам по международной номенклатуре.

Физические свойства.
Аминокислоты – бесцветные кристаллические вещества, хорошо растворяются в воде, температура плавления 230º – 300º. Многие α-аминокислоты имеют сладкий вкус.
|
|
|
Получение:
1. Гидролиз белков (как конечные продукты гидролиза).
2.Синтетический путь:
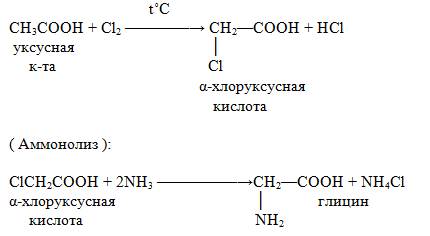
3.Из альдегидов:
: 
ИЗ предельных кислот
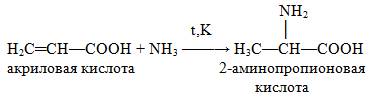
Из нитросоединений:

Химические свойства.
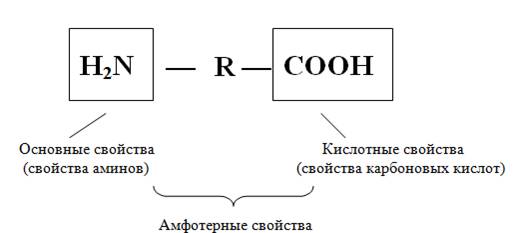
Реакции, идущие по карбоксильной группе:
1. Взаимодействие с основаниями:
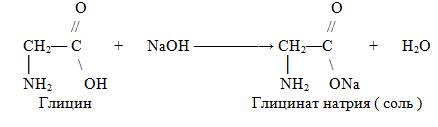
Взаимодействие со спиртами:
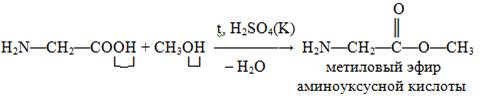
Реакции, идущие по аминогруппе:

Специфические свойства аминокислот:
1. Взаимодействие внутри молекулы, образование внутренних солей:
а) моноаминомонокарбоновые кислоты (нейтральные кислоты):
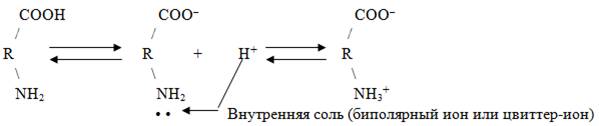
Водные растворы моноаминомонокарбоновых кислот нейтральны (рН ≈ 7).
б) моноаминодикарбоновые кислоты (кислые аминокислоты):

Водные растворы моноаминодикарбоновых кислот имеют рН < 7 (кислая среда), так как в результате образования внутренних солей этих кислот в растворе появляется избыток водорода Н+;
в) диаминомонокарбоновые кислоты (основные аминокислоты):

Водные растворы диаминомонокарбоновых кислот имеют рН > 7 (щелочная среда), так как в результате образования внутренних солей этих кислот в растворе появляется избыток гидроксид ионов ОН–.
2. Взаимодействие аминокислот друг с другом — образование пептидов.
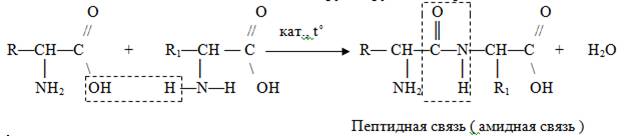
.Применение
1. 4-аминобутановая кислота (γ-аминомасляная кислота) ГАМК. Используется в медицине под названием аминадон или гаминалон, применяется при психических заболеваниях, обладает ноотропным действием, т.е. влияет на процессы мышления. На основе ГАМК созданы многие ноотропные средства.
3..Парааминобензойная кислота (ПАБК)

Парааминобензойная кислота (ПАБК)
Сложные эфиры ПАБК – анестезин, новокаин, используется в качестве местных анестезирующих средств.

Качественная реакция на аминокислоты:

51.Аминокислоты. Химические свойства: реакции карбоксильной группы, реакции аминогруппы. Отношение к нагреванию. Пептидная связь. (см вопрос 50)
52.Углеводы. Классификация. Номенклатура. Биологическая роль. Применение в медицине.
Классификация углеводов.
Все углеводы можно разделить на две группы: простые углеводы, или моносахариды, и сложные углеводы.
|
|
|
Простые углеводы (моносахариды) – это простейшие углеводы, не гидролизующиеся с образованием более простых углеводов.
Сложные углеводы – это углеводы, молекулы которых состоят из двух или большего числа остатков моносахаридов и разлагаются на эти моносахариды при гидролизе.
Биологическая роль.
Углеводы относятся к числу наиболее распространенных в природе органических соединений: они являются компонентами клеток всех растительных и животных организмов. Углеводы образуются растениями в процессе фотосинтеза:
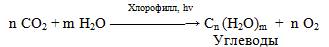
Животные не способны сами синтезировать углеводы и используют углеводы, синтезируемые растениями. Углеводы составляют значительную долю пищи млекопитающих.
В процессах дыхания происходит окисление углеводов, в результате чего выделяется энергия, необходимая для функционирования живых организмов:
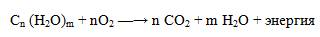
При полном окислении 1 г углеводов освобождается 17,6 кДж энергии. Некоторое количество выделяющейся энергии превращается в тепло, а большая часть ее аккумулируется в АТФ и затем расходуется в процессах жизнедеятельности.
Функции углеводов в живых организмах разнообразны.
Они служат источником запасной энергии (в растениях – крахмал, в животных организмах – гликоген). В растительных организмах углеводы являются основой клеточных мембран. В качестве одного из структурных компонентов остатки углеводов входят в состав нуклеиновых кислот.
53.Строение углеводов. Цикло-оксо-таутомерия. Оптическая изомерия моносахаридов. Формулы Фишера и Хеуорса.


54.Химические свойства моносахаридов. Реакции полуацетального гидроксила, реакции спиртовых гидроксилов, окисления, восстановления.
Моносахариды – это соединения со смешанными функциями.
В растворах существует динамическое равновесие между несколькими таутомерными формами моносахаридов, поэтому в зависимости от условий и реагентов они могут реагировать в открытой или циклической форме. При этом равновесие смещается в сторону образования той формы, которая вступает во взаимодействие.
Химические свойства моносахаридов обусловлеы наличием:
а) карбонильной группы в открытых формах моносахаридов;
б) спиртовых гидроксильных групп как в открытых, так и в циклических формах моносахаридов;
в) полуацетальной гидроксильной группой в циклических формах моносахари-
дов.
Рассмотрим химические свойства моносахаридов на примере важнейшего из них – глюкозы.
I. Реакции с участием альдегидной группы глюкозы, т.е. свойства глюкозы как альдегида.
|
|
|
1. Восстановление (гидрирование) с образованием многоатомного спирта:

В ходе этой реакции карбонильная группа  восстанавливается и образуется новая спиртовая группа — ОН.
восстанавливается и образуется новая спиртовая группа — ОН.
55.Дисахариды: сахароза, лактоза. Применение в медицине.
56.Жиры. Классификация. Номенклатура. Строение жиров. Биологическая роль жиров. Применение в фармации.
Жиры.
Жиры – это сложные эфиры, образованные высшими карбоновыми кислотами и трёхатомным спиртом глицерином. Общее название таких соединений – ТРИГЛИЦЕРИДЫ.
БИОЛОГИЧЕСКАЯ РОЛЬ ЖИРОВ И ПРИМЕНЕНИЕ В МЕДИЦИНЕ
В организме они выполняют следующие многообразные функции, в том числе:
1) структурную, так как являются необходимым компонентом клеточных мембран, которые состоят из белково-липидных компонентов;
2) регуляторную, так как отдельные представители липидов являются гормонами (кальцитриол, кортикостероиды) и витаминами (витамины D3, F);
3) влияют на активность мембрано - связанных ферментов;
4) транспортную, так как являются транспортной формой «метаболического топлива» в организме в виде липопротеинов, комплексов жирных кислот с альбуминами, жирорастворимых витаминов и т. д.;
5) участвуют в передаче нервного импульса;
6) являются растворителями для жирорастворимых витаминов A, D, Е, К;
7) обеспечивают теплоизоляцию и поэтому играют важную роль в процессах терморегуляции в организме;
8) энергетическую, так как липиды непосредственно используются в химических процессах как основное «метаболическое топливо», а также откладываются в запас в клетках жировой ткани (адипоцитах) на длительное время (в отличие от гликогена, который запасается на 24 часа).
9) защитную, предохраняя внутренние жизненно важные органы от сотрясений.
Применение жиров.
В фармации жиры широко используются как мазевые основы,
а масла - в приготовлении масляных растворах лекарственных средств.
В фармацевтической практике некоторые жиры применяют в качестве основы для мазей (свиное сало - Axungia porcina),
для линиментов - растирок (подсолнечное масло - Oleum helianti).
Многие масла применяют как растворители лекарственных веществ для введения под кожу: например камфору,
миарсенол и ряд других препаратов растворяют в оливковом - Oleum olivarum - или в персиковом масле.
Рыбий жир применяют как наружно, так и внутрь.
57.Физические свойства жиров. Химические свойства. Кислотный и щелочной гидролиз, гидрогенизация жиров, окисление.
Химические свойства
Гидрогенизация – это реакция, с помощью которой жидкие жиры превращаются в твёрдые.

Физические свойства:
Животные жиры – это твёрдые вещества.
Растительные жиры – жидкие вещества (называются по другому маслами).
Все жиры легче воды, в воде не растворимы, но растворимы в бензине, дихлорэтане, эфире, сероуглероде, тетрахлориде. Жиры хорошо впитываются бумагой и кожей.
Схема образования жиров
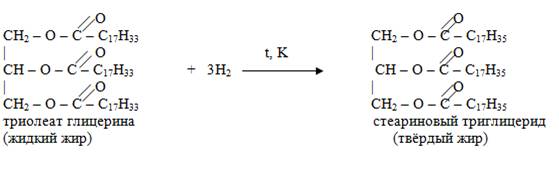
Кислотный гидролиз жиров
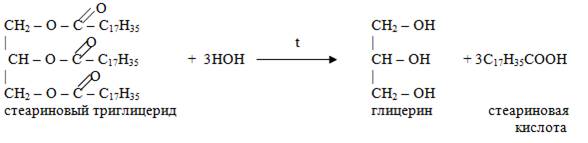
Щелочной гидролиз жиров
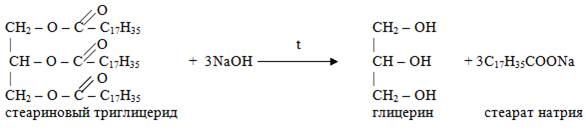
Окисление
Особенностью жиров содержащих ненасыщенные жирные кислоты, является способность окисляться кислородом воздуха по двойной связи. При этом образуется продукты окисления: альдегиды, карбоновые кислоты с более короткими цепями. Это ухудшает органолептические свойства жиров. Окислительные процессы при уменьшении доступа воздуха и в темноте, что определяет условия хранения лекарственных препаратов на жировой основе.
Гидрогенизация – это реакция, с помощью которой жидкие жиры превращаются в твёрдые

58.Белки. Строение. Пептидная связь. Первичная и вторичная структура. Биологическое значение белков. Физиологически активные пептиды.
Белки – это природные высокомолекулярные соединения (биополимеры), структурную основу которых составляют полипептидные цепи, построенные из остатков α-аминокислот.
Все белки являются полипептидами, но не всякий полипептид является белком. Каждый белок имеет свое специфическое (индивидуальное и постоянное) строение.
Строение белковых молекул.
Различают четыре уровня структурной организации белковых молекул.
Первичная структура белка – это число и последовательность аминокислотных остатков в полипептидной цепи. (Полипептидную теорию строения белков предложил немецкий химик Э. Фишер в начале XX века).
В организме человека свыше 10000 различных белков, и все они построены из одних и тех же 20 α-аминокислот (формулы некоторых из них приведены в табл. 490, которые соединены между собой пептидными связями. Число остатков аминокислот в молекулах белков варьирует от 50 до 105. Потенциально возможное число белков с различной первичной структурой практичеки не ограничено.
связь
R1, R2, R3, R4 – радикалы α-аминокислот
Один из первых белков, первичная структура которого была установлена в 1954г., - гормон инсулин (регулирует содержание сахара в крови), егомолекула состоит из двух полипептидных цепей, которые связаны друг с другом (в одной цепи 21 аминокислотный остаток, в другой – 30), Мr (инсулина)=5700.
Другой белок – фермент рибонуклеаза – состоит из 124 аминокислотных остатков и имеет Мr≈ 15000 (рис.20).
Белок крови – гемоглобин имеет Мr ≈68000.
Белки некоторых вирусов имеют Мr до 50 млн.
Относительная молекулярная масса белков изменяется в широких пределах: от 5 тыс. до десятков миллионов.
первичная структура белка.
Вторичная структура белка (для большинства белков) – это ά-спираль, которая образуется в результате скручивания полипептидной цепи за счет водородных связей между группами:
Теоретически все группы -CO и -NH-могут участвовать в образовании водородных свя-
зей, поэтому вторичная структура очень стабильна. В одном витке спирали обычно содержится 3,6 аминокислотного остатка.
Вторичная структура была установлена американским химиком Л. Полингом в 1951 г.
59.Денатурация белков. Качественные реакции на белки.
Денатурация белков – это нарушение нативной пространственной структуры белковой молекулы под влиянием различных внешних воздействий, сопровождающееся изменением их физико-химических и биологических свойств. При этом нарушаются вторичная и третичная структуры белковой молекулы, а первичная, как правило, сохраняется.
Денатурация белков происходит при нагревании и замораживании пищевых продуктов под действием различных излучений, кислот, щелочей, резких механических воздействий и других факторов.
При денатурации белков происходят следующие основные изменения:
- резко снижается растворимость белков;
- теряется биологическая активность, способность к гидратации и видовая специфичность;
- улучшается атакуемость протеолитическими ферментами;
- повышается реакционная способность белков;
- происходит агрегирование белковых молекул;
- заряд белковой молекулы равен нулю.
Потеря белками биологической активности в результате тепловой денатурации приводит к инактивации ферментов и отмиранию микроорганизмов.
В результате потери белками видовой специфичности пищевая ценность продукта не снижается.
Рассмотрим наиболее распространенную тепловую денатурацию белковых молекул, сопровождаемую разрушением слабых поперечных связей между полипептидными цепями и ослаблением гидрофобных и других взаимодействий между белковыми цепями. В результате этого изменяется конформация полипептидных цепей в белковой молекуле. Например, фибриллярные белки изменяют свою эластичность, у глобулярных белков развертываются белковые глобулы с последующим свертыванием по новому типу. Прочные (ковалентные) связи белковой молекулы при этом не нарушаются. Глобулярные белки изменяют растворимость, вязкость, осмотические свойства и электрофоретическую подвижность.
Для большинства белков температура денатурации составляет 45 - 60°С. Однако встречаются белки и термостабильные, например, a-лактоглобулин молока и a-амилазы некоторых бактерий. Повышенная устойчивость белков к нагреванию часто обусловливается наличием в их составе большого количества дисульфидных связей. Однако степень денатурирующего воздействия температуры на белки зависит и от их влажности, реакции и солевого состава среды и присутствия небелковых соединений. Например, температура денатурации белков сои и подсолнечника существенно понижается в присутствии кислот жирного рада, в кислой и влажной среде, но повышается в присутствии сахарозы и крахмала.
Качественная реакция на белки. Белки выявляются в основном на реакциях, основанных на окрасках.
Ксантопротеиновая реакция. Данная реакция обнаруживает ароматические аминокислоты, входящие в белки (на примере тирозина):
(OH)C6H4CH(NH2)COOH + HNO3 —-H2SO4——> (OH)C6H3(NO2)CH(NH2)COOH↓ + H2O — выпадает осадок желтого цвета.
(OH)C6H3(NO2)CH(NH2)COOH + 2NaOH ——-> (ONa)C6H3(NO2)CH(NH2)COONa + H2O — раствор становится оранжевым.
Обнаружение серосодержащих аминокислот:
Белок + (CH3COO)2Pb —NaOH—> PbS↓ (осадок черного цвета).
Биуретовая реакция для обнаружения пептидной связи (CO-NH):
Белок + CuSO4 + NaOH ——> красно-фиолетовое окрашивание.
Спецефический запах при горении:
Белок —-обжиг—-> запах паленой шерсти.
60.Гетероциклические соединения. Классификация. Номенклатура.
Гетероциклические соединения- это циклические соединения,
содержащие в цикле кроме атома "С", атомы других элементов
(гетероатомы), чаще всего атомы азота, кислорода или серы.
Гетероциклические соединения входят в состав многих веществ
природного происхождения: хлорофилл, гем крови, нуклеиновые
кислоты,пенициллины,витамины, почти все алкалоиды. Более половины
лекарственных веществ содержат в своей структуре гетероциклы.
2. Гетероциклические соединения делятся на группы в зависимости
от числа атомов в цикле.
2.Классификация и номенклатура
 Пятичленные гетероциклы с одним гетероатомом
Пятичленные гетероциклы с одним гетероатомом

Пятичленные гетероциклы с двумя гетероатомоми

Шестичленные гетероциклы с одним и двумя гетероатомами

Конденсированные системы гетероциклов

 Дибазол
Дибазол
61.Гетероциклические соединения. Ароматичность. Пиррольный и пиридиновый атомы азота-зависимость между их строением и свойствами соединений.
62.Химические свойства гетероциклических соединений: кислотно-основные, реакции электрофильного замещения.
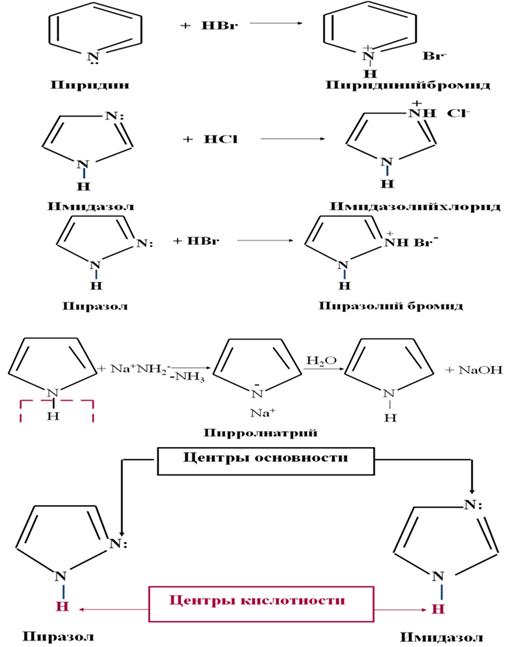
Кислотно-основные свойства гетероциклов.
Основные свойства обусловлены наличием гетероатома с неподеленной парой электронов, способной принимать протон. Такими свойствами обладает пиридиновый атом азота, у которого неподеленная пара электронов не участвует в сопряжении и находится на sp2-орбитали.
Соединения, содержащие пиррольный атом азота, не атакуются протоном, так как неподеленная
пара электронов пиррольного атома азота находится на негибридизированной р-орбитали и участвует в сопряжении. По этой же причине не проявляют основных свойств пиррол, фурон и
тиофен. Однако, пиррольный атом азота, связанный с атомом водорода, может служить центром
кислотности. Пиррол ведет себя как слабая N-H кислота.
63.Пятичленные гетероциклы с одним гетероатомом: фуран, тиофен, пиррол. Фурацилин.


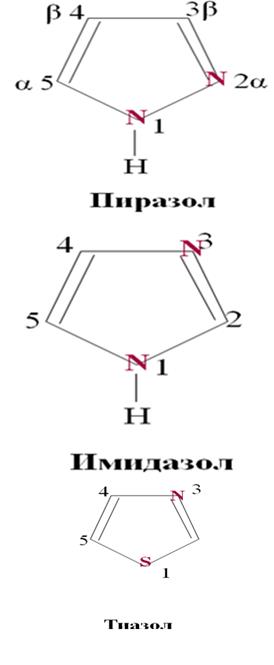
64.Пятичленные гетероциклы с двумя гетероатомами. Диазолы: пиразол, имидазол, тиазол. Анальгин. Дибазол.

65.Шестичленные гетероциклы с одним гетероатомом. Азины. Пиридин. Никотиновая кислота.
Никотиновая кислота

Пиридин

Азины
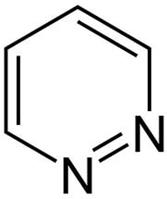
66.Шестичленные гетероциклы с двумя гетероатомами. Диазины. Пиримидин. Барбитуровая кислота. Барбитураты.
Диазины
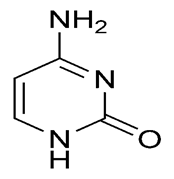
Пиримидин

Барбитуровая кислота

67.Конденсированные гетероциклы. Пурин. Ксантин. Теофиллин. Теобромин. Кофеин.
Пурин

Ксантин
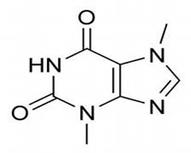
Кофеин

Теофилин

Теобромин
ё
|
|
|


