 |
Графические формулы химических соединений
|
|
|
|
Классификация основных классов неорганических веществ. Составление формул и номенклатура химических соединений. Графические формулы химических соединений. Получение химических соединений. Важнейшие свойства химических соединений. особенности взаимодействия химических элементов с кислотами и щелочами.
Простое- вещество молекулы которого состоят из атомов одного и того же химического элемента.
Сложное-молекулы состоят из атомов различных хим. Элементов
Оксид - сложное вещество состоящее из 2х элементов, одним из которых является кислород в степени окисления -2
· Основные оксиды- оксиды металлов, степень окисления которых 1-2 CaO, Na2O, FeO
· Кислотные оксиды металлов со степенью окисления 4-6, и оксиды неметаллов (CO2, N2O5, SO3) CO, SiO, Al20- не образуют солей, FeO*FeO3-оксид солеобразующий
Гидроксиды - это гидратное (водное) соединение оксида.
· Основные (основания)- только гидроксиды металлов со степенью оксиления +1, +2, проявляющие основные свойства ( Ca(OH)2, KOH, NaOH) при реакциях и диссоциации отщепляется группа OH
· Кислотные-гидроксиды неметаллов и металлов со степенью окисления +5 +6 проявляющие кислотные свойства( HNO3, H2SO4, H2SO3)
· Амфотерные-гидроксиды металлов со степенью окисления +3 +4 и несколько металлов со степенью окисления +2, которые проявляют амфотерные свойства.
Оксиды щелочных и некоторых щелочноземельных металлов взаимодействуют с водой образуя щелочи: Na2O+H2O= 2NaOH, нерастворимыеоснования при нагревании как правило разлагаются на оксид и воду: 2Fe(OH)3 =Fe2O3+3H2O, Cu(OH)2=CuO+H2O
Щелочи - хорошо растворимые в воде основания. Щелочи как основания взаимодействуют с кислотами с образованием соли и воды (реакция нейтрализации). NaOH+HCL=NaCL+ H2O; NaOH+HNO3=NaNO3+H2O.
|
|
|
Щелочи взаимодействуют с кислотными оксидами с образованием соли и воды: Ca(OH)2 +CO2=CaCO3 (осадок)+H2O
С амфотерными косидами: 2KOH+ZnO=(темп. )K2ZnO2+H2O
С растворами солей щелочь взаимодействует если образуется нерастворимое основание или нерастворимая соль: 2NaOH+CuSO4=Cu(OH)2(осадок)+N; Ba(OH)2+Na2SO4=2NaOH+BaSO4(осадок)
Кислоты - элементы которые при диссоциации выделяется ион Н
По содержанию атомов кислорода: бескислородные (HCL, H2S) кислородсодержащие (HNO3, H2SO4. По количеству кислых атомов водорода: одноосновные-HNO3 двухосновные-H2SeO4 трехосновные-H3PO4, H3BO3 многоосновные
По силе: сильные- диссоциируют практически полностью, константы диссоциации больше 1*10^-3 (HNO3) слабые- константа диссоциации меньше 1*10^-3 (уксусная кислота Кд=1, 7*10^-5
По растворимости: растворимые(H2SO4) нерастворимые (H2SiO3)
Соли- сложные вещества состоящие из катиона металла и аниона кислотных остатков
Средние - продукты замещения всех катионов водорода в молекулах кислоты на катионы металла( полная нейтрализация кислоты и основания) -Na2Co3, K3PO4
Кислые - продукты частичного замещенич катионов водорода в кислотах на катионы металла (неполной нейтрализации кислоты). NaHCO3, K3PO4
Основные - продукты неполного замещения гидроксoгрупп основания -OH кислотными остатками( неполная нейтрализация основания кислотой). Образуются в условиях избытка основания или недостатка кислоты
Комплексные - соли содержащие комплексный ион Na[Zn(OH)4]; [Fe(CO)5]
Двойные- соли, состоящие из одного кислотного остатка и катионов нескольких металлов CaMg(CO3)2-Доломит (карбонат кальция-магния) K2Ca(SO4)2 *H2O- сингенит ( сульфат кальция калия
Смешанные - соли состоящие из нескольких кислотных остатков и одного катиона. Хлорная известь- CaCLCLO-гипохлорид кальция (хлорка)
Графические формулы химических соединений
Графическая формула- схематичное изображение строения молекул когда химические связи заменяются точками или тире. Правила составления: 1. расставитьстепени окисления у всех элементов молекул. Количество связей=степениокиления. 2. Водород и щелочные металлы соединяются с другими элементами через кислород. 3. за основу берется элемент у которого больше всего связей
|
|
|
2. Основные понятия и законы химии
Атом, химический элемент, молекула, количество вещества, моль. Относительная и абсолютная атомная и молярная масса. Газовые законы, закон Авогадро, уравнение Менделеева-Клайперона. Закон сохранения массы, закон постоянства состава. Эквивалент, молярная масса эквивалента, эквивалентный объем. Определение молярных масс эквивалентов простых и сложных веществ, веществ в реакциях. Закон эквивалентов.
Атом -наименьшая часть химического элемента. Состоит из ядра и электронного облака. Ядро состоит из протонов и нейтронов.
Химический элемент - совокупность атомов с одинаковым зарядом атомных ядер и одинаковым числом электронов в атомной оболочке.
Молекула - электрически нейтральная частица, образованная из двух и более связанных атомов
Количество вещества - физическая величина характеризующая количество однотипных структурных единиц, содержащихся в веществе.
Моль - количество вещества которое содержит столько структурных частиц, сколько атомов содержится в 12 г изотопа углерода с массовым числом 12 V(ню)=m/M
Относительная атомная масса(Аr )- масса одного атома, выраженная в атомных единицах массы (а. е. м)показывает во сколько раз масса атома больше 1/12 массы атома углерода. 1а. е. м. -величина равная 1/12 массы атома углерода.
Абсолютная масса - равная относительной атомной массе, умноженной на 1 а. е. м.
Молярная масса - масса вещества количеством 1 моль. Молярная масса численно равна относительной молекулярной массе.
Молярная масса- масса 1эквивалента выражено в граммах.
Mэ прост. вещества= А/W; Mэ сложного=M/n*W А-атомная масса, W-валентность
Mэ реакции=M/число замещ. функци. групп Mэ (овр)=M/число отд. или присоед. Электронов
Мэ слож. в-ва=сумма Мэ(прост. вещества)
Объединенный газовый закон Бойля Мариотта и Гей Люссака: 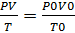 Р0, V0, T0-давление, объем газа и температура при нормальных условиях (Р=101, 3кПа, Т=273К, объем=22. 4л)
Р0, V0, T0-давление, объем газа и температура при нормальных условиях (Р=101, 3кПа, Т=273К, объем=22. 4л)
|
|
|
Закон Авогадро -закон, согласно которому в равных объемах различных газов, взятых при одинаковых температурах и давлениях, содержится одно и то же количество молекул. 
Уравнение к. менделеева PV= 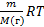 ; m=PVM/PV; M()=m R T /PV
; m=PVM/PV; M()=m R T /PV
Закон сохранения массы -масса веществ, вступающих в реакцию, равна массе веществ образ. В результате реакции.
Закон постоянства состава - любое химически чистое соединение независимо от способа его получения, состоит из одних и тех же химических элементов, и отношение их масс постоянны.
Закон эквивалентов реагирующие друг с другом в количестве пропорциональном их молярным массам эквивалентов. Э-эквивалент (моль) Мэ- Молярная масса эквивалента.
m1/Mэ1=m2/Mэ2; m /Mэ= V0/Vэ; w1/Mэ1=w2/Mэ2; x*M1/Mэ1=y*M2/Mэ2
m, m1, m2массы веществ M M1 M2молярные массы эквивалентов w1 w2 % содержащегося вещества x y стеометрические коэффициенты V0- объем приведенный к нормальным условиям Vэквивалентный объем
Эквивалент (Э)- количество вещества, которое присоединяет, замещяет, высвобождает или каким либо другим образом эквивалентно одному протону в кислотно-основных реакциях (H) или одному электрону в окислительной восстановительных реакциях (e) Э> =1
Эквивалентная концентрация- количество эквивалентов растворенного вещества, содержащегося в одном литре раствора К=m/Mэ
|
|
|


