 |
Основы химической кинетики и катализа. Химическое равновесие
|
|
|
|
Определения и основные понятия термодинамики, химическая термодинамика (термодинамическая система, фаза, компонент, энергия). Классификация и свойства термодинамических систем. Термохимия. Определения, термохимическое уравнение, экзо- и эндотермические процессы. Законы термохимии( закон Лавуазье-Лапласса, закон Гесса)
Характеристические функции состояния термодинамических систем, связь с ихпараметрами систем и друг с другом. Внутренняя энергия. Первый закон термодинамики. Энтальпия, изменение энтальпии, стандартная энтальпия образования. Энтропия, Определения энтропии (вероятностное, энергетическое, техническое и т. д) Энтропия процесса, стандартная энтропия. Второй закон термодинамики. Энергия Гиббса. Стандартная энергия Гиббса образования. Изменение энергии Гиббса. Критерии направления термодинамических процессов, мера необратимости процессов (дельтаS). Критерии принципиальной возможности и невозможности химических процессов (дельта G)
Химическая термодинамика- наука, изучающая превращения одних видов энергии и работы в другие.
Энергия(Q)- количественная мера движения, выражающаяся способностью материальных объектов совершать работу.
Существуют 2 формы передачи энергии: 1. упорядоченная (это работа) 2. неупорядоченная (это теплота)
Общая энергия Q -кинетическая энергия V + потенциальная энергия Eп + кинетическая энергия Eк
Термодинамическая система - комплекс взаимодействующих друг с другом хим. Объектов мысленно или реально обособленных от окружающей среды.
Фаза - часть системы, обладающая одинаковым химическим составом и одинаковыми параметрами и отделенная от других фаз поверхностью раздела
|
|
|
Компоненты - независимые составляющие с помощью которых можно охарактеризовать состав фазы.
По характеру взаимодействия с окружающей средой различают системы
· изолированные, не обменивающиеся с внешней средой ни энергией, ни веществом;
· адиабатически изолированные, не обменивающиеся с внешней средой веществом, но допускающие обмен энергией в виде работы
· закрытые, обменивающиеся с внешней средой энергией, но не обменивающиеся веществом;
· открытые, обменивающиеся с внешней средой и энергией, и веществом;
· частично открытые, обменивающиеся с внешней средой и энергией, и веществом, но у которых не все составляющие вещества принимают участие в материальном обмене (например, из-за наличия полупроницаемых перегородок
Закон Лавуазье-Лапласа: теплота образования соединения равна теплоте разложения его, но с обратным знаком Δ Нº обр= –Δ Нº разл.
Закон Гесса: тепловой эффект хим. Реакции не зависит от пути перехода системы из начального состояния в конечноеΔ Нреакц= Δ Нст1+ Δ Нст2+ Δ Нст3+ Δ Нст... следствие: стандартный тепловой ффект реакции равенразности сумм стандартных теплот образования продуктов реакции и стандартных теплот образования веществ. Δ Hх. р. =сумма Δ Hпродуктов-Δ Hисходн.
А если не стандартный тепловой эффект то уравнение Киргофа: Δ Нх. р. =Δ Н(тау)+ 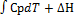
Внутренняя энергия- энергия поступательно вращательного движения молекул колебательного движения молекул, колебательного движения атомов в молекуле, энергия движения электронов, энергия ядерных сил. Внутр. Энергия то, что внутри системы. Н-энтальпия. Абсолютного значения нет, так что необходимо вычислять Δ Н: Δ Н=Δ V+p Δ V
Стандартная энтальпия образования- изменение энтальпии при образовании 1 моля вещества, находящегося в стандартном состоянии, из простыхвеществ, находящихся в стандартном состоянии.
|
|
|
Энтальпия реакции
Основы химической кинетики и катализа. Химическое равновесие
Актуальность раздела. Предмет химической кинетики. Скорость химической реакции. Факторы влияющие на скорость химической реакции. Влияние концентрации на скорость реакции,. Закон действующих масс для скорости реакйии. Влияние температуры на скорость реакции. Кинетические уравнения. Порядок и молекулярность реакций. Влияние температуры на скорость реакций. Правило Вант Гоффа. Уравнение Аррениуса. Энергия и энтропия активации. Понятие активированного комплекса. Энергетические профили реакций. Влияние катализаторов на скорость реакции.
Скорость реакции - изменение концентрации реагирующих веществ в единицу времени в единице объема для гомогенных реакций и на единицу площади поверхности для гетерогенных реакций. V(вектор)=dc/dt=Δ Cм/Δ t(тау) [моль/литр*с]; V=1/t(тау)[с^-1]
Влияние на скорость: 1. Концентрация. 2. Температура 3. катализатор(ингибитор) 4. энергия активации 5. энтропия активации 6. Природа вещества 7. площаль поверхности
Влияние концентрации на скорость: закон действующих масс: при постоянной температуре скоростьхимических реакций прямопропорционально произведению концентрации реагирующих или образующих веществ в степенях ихпоказателей по реагентам.
Влияние температуры: правило вант гоффа: при изменении температуры на каждые 10 градусов скорость реакции менчется в 2-4 раза V2/V1=Ɣ ^T2-T1/10; K2/K1=Ɣ ^T2-T1/10; Tтау1/Tтау2=Ɣ ^T2-T1/10
Более точно выражается уравнением Аррениуса: k=Aē ^Eакт/RT_ *e^Δ S/R; k=Ae^-Eакт/RT. А-предэкспонициальный множитель учитывающий количество столкновений активных молекул, Еакт-избыточная энергия, Δ S-энтропия активации.
Энергия активации в химии — минимальное количество энергии, которое требуется сообщить системе (в химии выражается в джоулях на моль), чтобы произошла реакция.
Энтропия активации рассматривается как разность энтропии переходного состояния и основного состояния реагентов. Она определяется главным образом потерей трансляционной и вращательной степеней свободы частиц при образовании активированного комплекса. Существенные изменения (колебательной степени свободы могут также произойти, если активированный комплекс несколько более плотно упакован, чем реагенты. Если энергия активации меньше 100 кДж/моль, то такая реакция ротекает с маленькой скоростью. Если меньше 50 кДж/моль то реакция протекает с большой скоростью.
|
|
|


