 |
Противоречи планетарной модели строения атома. Постулаты Бора
|
|
|
|
Химическое равновесие. Термодинамический и кинетический признаки химического равновесия. Константа химического равновесия(закон действующих масс для химического равновесия). Величина константы равновесия в зависимости от ее размерности и способа изерения концентрации. Связь Кс с Кр и Kf. Принцип Ле-шателье. Факторы, влияющие на смещение химического равновесия. Связьэнергии Гиббса с константой химического равновесия.
Химическое равновесие- состояние когда скорость прямой реакции равна скорости обратной V→ =V←, Δ G=0, , Δ H=T, Δ S. Химическое равновесие характеризуется константой равновесия.
Закон действующих масс для химического равновесия: при постоянной температуре отношениеп произведения равновесных молярных концентраций продуктов реакции в степенях их стехиометрических коэффициентов к произведению равновесно молярных концентраций их веществ в степенях их стех. коэф. Кс=[HI]^2/[H2][I2]- пример здм для хим. реакции. моль/л Кс зависит от температуры, природы реагирующего вещества, ине зависит от концентрации и катализатора
Кр=P^2 (HI)/P(H2)*P(I2). Р-парциальное давление, которое оказывает вещество в смеси. Кр=Кс(RT)^Δ n. , Δ п-разница количества молей продуктов и исходных веществ. Здм учитывает только газы и жидкости, твердые вещества не учитываются. Δ Gх. р=-2. 303 RT lg Kc Δ Gх. р. < 0, если lg Кс> 0. Кс> 1 реакция идет; Δ Gх. р. > 0 lgKc < 0, Kc< 1
Принцип Ле-шателье: если на систему наход. В равновесии оказывает какое-либо воздействие, то в ней возникают силы противодействия. 1) влияние на хим. Равновесие а)при увеличении температуры хим. равновесие смещается в сторону эндотермического процесса б) при уменьшении температуры в сторону экзотермического процесса. Δ Нх. р. =∑ Δ Hпродукта-∑ Δ Нисходных. Δ Н хр=-Q; Q=m*Cp*Δ t (Ср-теплоемкость табличное значение. )
|
|
|
2) влияние давления
А) при увеличении давления хим. равновесии смещается в сторону меньшего числа молей газов. Б) при уменьшении давления хим. равновесие смещается в сторону большего числа молей газов. Если число молей равно, то давление не влияет.
3) влияние объема обратно давлению
4) влияние концентрации смотрится по константе равновесия
Стандартное изменение энергии Гиббса для реакции А+В→ АВ равно начальной концентрации А и В по 1 моль на литр. Найти константу равновесия. К с=0. 04. как найти равновесие: Кс=[AB]/[A][B]; [A]=[A]0-[AB]
Планетарная модель строения атома. Строение атома (ядро, электрон, протон нейтрон, нуклоны). Изотопы, изотоны, изобары. Строение ядер. Противоречия планетарной модели строения атома. Постулаты Бора. Теория строения Бора-Зоммерфельда.
Планета́ рная моде́ ль а́ тома, или модель атома Резерфо́ рда, — исторически важная модель строения атома, предложенная Эрнстом Резерфордом в классической статье[1], опубликованной в 1911 г. на основании анализа и статистической обработки результатов экспериментов по рассеиванию альфа-частиц в тонкой золотой фольге, выполненных Гейгером и Марсденом в 1909 г. В этой модели Резерфорд описывает строение атома состоящим из крохотного положительно заряженного ядра, в котором сосредоточена почти вся масса атома, вокруг которого вращаются электроны, — подобно тому, как планеты движутся вокруг Солнца.
Ядро атома состоит из нуклонов: протонов и нейтронов. Общее число нуклонов в ядре называют массовым числом А. Число протонов в ядре равно порядковому номеру в системе элементов Менделеева Z (числу протонов в ядре или числу электронов в атоме), число нейтронов
Ядро обозначают символом.
Ядра могут иметь несколько изотопов, характеризующимися одним и тем же порядковым номером Z, но различными А и N. Например, – ядро водорода – протон; – ядро дейтерия – дейтрон (d); – ядро трития – тритон (t).
|
|
|
Электрический заряд ядра равен числу положительно заряженных протонов в ядре. Размеры ядер зависят от числа нуклонов в ядре, и как у всякой квантовой системы у атомного ядра нет четко выраженной границы.
Протон - элементарная частица в составе атомного ядра массой 1, 67-10~24 г, имеющая положительный заряд 1, 6-10" 19 Кл. Протон был открыт в 1920 г. английским физиком Э. Резерфордом.
Нейтрон - элементарная частица в составе атомного ядра массой 1, 67 •10~24 г. Не заряжена. Нейтрон был открыт в 1932 г. английским физиком Дж. Чедвиком. Сумму протонов и нейтронов называют нуклонами.
В состав ядра, кроме протонов и нейтронов, входит множество других микрочастиц,
ЭЛЕКТРО́ НЭлементарная частица с наименьшим отрицательным электрическим зарядом.
Нукло́ ны — общее название для протонов и нейтронов. С точки зрения электромагнитного взаимодействия протон и нейтрон — разные частицы, так как протон электрически заряжен, а нейтрон — нет.
Изотопы - разновидности атомов, имеющих одинаковые заряды ядер, но разные атомные массы (за счет разного числа нейтронов в ядре), напри мер, Mg и Mg, С1и С1.
94 9S " 3S37
Самопроизвольное превращение неустойчивого изотопа одного химического элемента в изотоп другого элемента, сопровождающееся испусканием элементарных частиц или ядер (ос-частицы), называется радиоактивностью.
Изобары - это атомы, имеющие одинаковые массовые числа, но различные заряды ядер и разные химические свойства. Например, атомы аргона, калия и кальция - 40Аг, 40К, 40Са.
Ядра с одинаковым числом протонов и разным числом нейтронов называются изотопами. Ядра с одинаковым числом нейтронов, но разным числом протонов — называются изотонами.
Противоречи планетарной модели строения атома. Постулаты Бора
Основным недостатком планетарной модели строения атома Резерфорда было ее противоречие теории классической электродинамики, которая утверждает, что, двигаясь по круговой орбите, электрон как заряженная частица должен непрерывно излучать энергию и " достаточно быстро упасть на ядро". Нильс Бор пришел к выводу, что микрочастицы отличаются по свойствам от макрообъектов, поэтому классической электродинамики недостаточно для их описания. В своей теории Бор использовал представления классической механики о движении заряженной частицы в электрическом поле, дополнив их идеями квантования энергии. При этом он выдвинул три постулата (постулат – утверждение в теории, принимаемое за истинное, хотя и недоказуемое в рамках этой теории).
|
|
|
Первый постулат. Электроны в атоме могут двигаться только по некоторым определенным устойчивым стационарным круговым орбитам. При движении по этим орбитам электроны не излучают энергию, то есть существует ряд стационарных состояний атома, соответствующих определенным значениям его энергии.
Второй постулат. При переходе электрон с одной стационарной орбиты на другую атом испускает или поглощает квант электромагнитного излучения, энергия которого (hn) равна разности энергий стационарных состояний: hn=E1–E2,
где h – постоянна планка, n – частота излучения.
Третий постулат. В атоме существуют только такие электронные орбиты, находясь на которых электрон обладает моментом количества движения, кратным  (часто вводят обозначение
(часто вводят обозначение 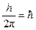 ):
):
M = m× v× r = 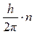 ,
,
где M – момент количества движения электрона; m = 9, 11× 10-31 кг – масса электрона; v – скорость электрона; r – радиус орбиты электрона; h = 6, 63× 10-34Дж× с – постоянная Планка; n = 1, 2, 3... – целое число, получившее название «квантовое число».
Используя эти постулаты, Бор рассчитал размеры стационарных орбит электронов в атоме, энергию электронов на стационарных орбитах и выразил постоянную Ридберга через основные константы.
|
|
|


