 |
Изменение свойств химических элементов в зависимости от положения в периодической системе.
|
|
|
|
Связь электронного строения атомов с положением их в Периодической системе. Периодический закон Менделеева и его графическое выражение. Структура периодической системы: периоды, группы. Изменение свойств химических элементов в зависимости от положения в периодической системе.
Рассмотрим связь между положением элемента в периодической системе и электронным строением его атомов. У каждого последующего элемента периодической системы на один электрон больше, чем у предыдущего. Полные записи электронных конфигураций (формул) первых двух периодов приведены в табл. 1. 3. Первый период состоит из двух элементов: водорода и гелия (Z=2). Оба элемента являются s-элементами. Атомом гелия заканчивается формирование первого уровня (K-оболочки; n = 1) атома, обозначим её [He].
У элементов второго периода формируется второй энергетический уровень (L – оболочка; n = 2), заполняются s- и p- подуровни. Li (Z = 3) и Be (Z=4) относятся к s –элементам, остальные шесть элементов периода входят в число p-элементов. У элемента Ne (Z=10) полностью заполнен 2p –подуровень, обозначим его электронную конфигурацию как [Ne]. Электронные конфигурации элементов в основном состоянии в краткой записи представлены в приложении 1(запись электронной конфигурации полностью заполненных подуровней предыдущих периодов не приводится). У элементов 3-го периода заполняется третий уровень (оболочка М; n=3), состоящий из 3s-, 3p- и 3d-орбиталей. Начинается период с натрия (Z=11), электронная конфигурация которого 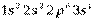 , и заканчивается аргоном (Z=18), с электронной конфигурацией
, и заканчивается аргоном (Z=18), с электронной конфигурацией 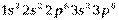 .
.
Натрий – аналог лития, аргон – неона. В третьем периоде, так же, как и во втором, восемь элементов, из них два первых элемента Na(Z=11) и Mg(Z=12) являются s-элементами, шесть последних (Al - Ar) – p-элементами.
Хотя в третьем уровне (оболочка М) имеется подуровень 3d, который остается незаконченным, в четвертом периоде начинает формироваться следующий уровень- четвертый (оболочка N; n=4) и период начинается с s- элемента калия (Z=19).
|
|
|
Внешний 4s - электрон придает элементу свойства, сходные со свойствами натрия. Появление электрона в 4s-состоянии при наличии свободных 3d-орбиталей обусловливается экранированием(заслонением) ядра плотным и симметричным электронным слоем.
То есть энергия 4s–подуровня несколько ниже, чем энергия 3d–подуровня (см. рис. 2. 4). В соответствии с правилом Клечковского, (n+ℓ ) у 4s(4) ниже, чем (n+ℓ ) у 3d (5). С элемента скандия (Z=21) начинается заполнение 3d-подуровня, так как он энергетически более выгоден, чем 4p-подуровень. Пять орбиталей 3d-подуровня могут быть заняты десятью электронами, что осуществляется у атомов от скандия до цинка (Z=30). Элементы от 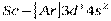 до
до 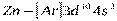 относятся к d-элементам. У d - элементов 4-го периода, следовательно, достраивается слой М (третий уровень; n=3) до 18 электронов. В связи с этим важно отметить, что физические и химические свойства элементов в первую очередь определяются структурой внешнего энергетического слоя их атомов и лишь в меньшей степени зависят от строения предшествующих (внутренних) электронных слоёв. У атомов всех d-элементов внешний слой образован одним, двумя s-электронами, поэтому химические свойства d-элементов с увеличением порядкового номера изменяются не так резко, как свойства s- и p-элементов. Все d-элементы принадлежат к металлам, тогда как заполнение внешнего p-подуровня приводит к переходу от металла к типичному неметаллу и, наконец, к благородному (инертному) газу.
относятся к d-элементам. У d - элементов 4-го периода, следовательно, достраивается слой М (третий уровень; n=3) до 18 электронов. В связи с этим важно отметить, что физические и химические свойства элементов в первую очередь определяются структурой внешнего энергетического слоя их атомов и лишь в меньшей степени зависят от строения предшествующих (внутренних) электронных слоёв. У атомов всех d-элементов внешний слой образован одним, двумя s-электронами, поэтому химические свойства d-элементов с увеличением порядкового номера изменяются не так резко, как свойства s- и p-элементов. Все d-элементы принадлежат к металлам, тогда как заполнение внешнего p-подуровня приводит к переходу от металла к типичному неметаллу и, наконец, к благородному (инертному) газу.
После заполнения 3d-орбиталей у последующих шести элементов (Ga-Kr) заполняются p-орбитали внешнего слоя. Четвертый период завершается формированием подуровня 4р у криптона – [Ar] 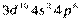 или [Kr], являющегося аналогом аргона. Всего в четвертом периоде 18 элементов. Таким образом, четвертый период начинается двумя s-элементами и заканчивается шестью р-элементами, но в отличие от второго и третьего периодов между s- и p-элементами располагаются десять d-элементов (вставная декада большого периода; переходные элементы).
или [Kr], являющегося аналогом аргона. Всего в четвертом периоде 18 элементов. Таким образом, четвертый период начинается двумя s-элементами и заканчивается шестью р-элементами, но в отличие от второго и третьего периодов между s- и p-элементами располагаются десять d-элементов (вставная декада большого периода; переходные элементы).
В пятом периоде заполнение электронных уровней и подуровней происходит, как и в четвертом периоде, а именно: у двух первых элементов (s-элементов 37Rb и38Sr) и шести последних (р - элементов 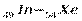 ) заполняется внешний слой. Между s- и р - элементами располагаются десять d – элементов (
) заполняется внешний слой. Между s- и р - элементами располагаются десять d – элементов ( 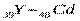 ), у которых заполняются d – орбитали предвнешнего уровня (4d - подуровень). Всего в пятом периоде 18 элементов.
), у которых заполняются d – орбитали предвнешнего уровня (4d - подуровень). Всего в пятом периоде 18 элементов.
|
|
|
Шестой период содержит 32 элемента (см. приложение 1) и тоже начинается двумя s – элементами (  и
и 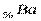 ). Далее у лантана начинает заполняться d – орбиталь предвнешнего уровня (5d - подуровень):
). Далее у лантана начинает заполняться d – орбиталь предвнешнего уровня (5d - подуровень):
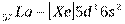 .
.
После чего заполнение этого подуровня приостанавливается, а начинает заполняться энергетически более выгодный 4f – подуровень (рис. 2. 4), семь орбиталей которого могут быть заняты 14 электронами. Это происходит у 14 атомов элементов лантаноидов 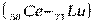 , относящихся к f – элементам. Поскольку у этих элементов заполняется глубинный 4f – подуровень третьего снаружи уровня, они обладают близкими химическими свойствами. С гафния (Z=72) возобновляется заполнение 5d подуровня и заканчивается у ртути (Z=80), после чего электроны заполняют 6р – подуровень: шестой период, как и пятый, завершается шестью р – элементами
, относящихся к f – элементам. Поскольку у этих элементов заполняется глубинный 4f – подуровень третьего снаружи уровня, они обладают близкими химическими свойствами. С гафния (Z=72) возобновляется заполнение 5d подуровня и заканчивается у ртути (Z=80), после чего электроны заполняют 6р – подуровень: шестой период, как и пятый, завершается шестью р – элементами 
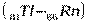 . В шестом периоде 32 элемента, из них: два s – элемента, шесть р – элементов, десять d – элементов и четырнадцать f – элементов.
. В шестом периоде 32 элемента, из них: два s – элемента, шесть р – элементов, десять d – элементов и четырнадцать f – элементов.
В седьмом периоде имеются два s – элемента 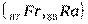 , за ними следуют d – элемент
, за ними следуют d – элемент 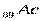 и четырнадцать f – элементов - актиноидов
и четырнадцать f – элементов - актиноидов 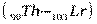 , далее снова d – элементы (
, далее снова d – элементы ( 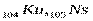 , элементы 106 - 110). Актиноиды, как и лантаноиды, обладают многими сходными химическими свойствами. В противоположность предыдущим, 7-й период не завершён.
, элементы 106 - 110). Актиноиды, как и лантаноиды, обладают многими сходными химическими свойствами. В противоположность предыдущим, 7-й период не завершён.
Изложенное показывает, что по мере роста заряда ядра происходит закономерная периодическая повторяемость сходных электронных структур элементов, а следовательно, и повторяемость их свойств, зависящих от строения электронных оболочек атомов.
Периодическая система Д. И. Менделеева отражает периодический закон, является естественной классификацией химических элементов по электронной структуре их атомов.
|
|
|
Периодический закон Д. И. Менделеева : Свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов.
Периодическая система элементов. Ряды элементов, в пределах которых свойства изменяются последовательно, как, например, ряд из восьми элементов от лития до неона или от натрия до аргона, Менделеев назвал периодами. Если напишем эти два периода один под другим так, чтобы под литием находился натрий, а под неоном — аргон, то получим следующее расположение элементов.
При таком расположении в вертикальные столбцы попадают элементы, сходные по своим свойствам и обладающие одинаковой валентностью, например, литий и натрий, бериллий и магний и т. д.
Разделив все элементы на периоды и располагая один период под другим так, чтобы Сходные по свойствам и типу образуемых соединений элементы приходились друг под другом, Менделеев составил таблицу, названную им периодической системой элементов по группам и рядам.
Период - это совокупность элементов, расположенных в порядке возрастания зарядов их ядер, в атомах которых электроны распределены по одному и тому же числу энергетических уровней. Число уровней, на которых распределяются электроны, равно номеру периода. Поскольку для находящихся в невозбужденном состоянии атомов известных элементов электроны заполняют энергетические уровни от первого до седьмого, периодическая система включает семь периодов. Каждый период содержит определенное число элементов, регламентируемое принципом Паули, который обуславливает конечную емкость энергетических уровней и подуровней, и правилом Клечковского, определяющим порядок заполнения уровней и подуровней электронами.
Группа - это совокупность элементов с одинаковым числом валентных электронов, т. е. электронов на орбиталях высшего уровня и на недостроенных внутренних подуровнях.
|
|
|
В периодической системе можно выделить семь групп, отвечающих приведенному выше определению, для которых номер группы совпадает с числом валентных электронов; эти группы открываются такими элементами как литий, бериллий, бор, углерод, азот, кислород, фтор. К первой группе по числу валентных электронов следовало бы отнести также водород, однако этот элемент, как уже отмечалось, по физическим и химическим свойствам стоит ближе к галогенам, чем к щелочным металлам. С галогенами водород сближает и то, что для построения структуры благородного газа ему не хватает одного электрона. В силу этого водород относят и I, и к VII группе. Лантаноиды и актиноиды по группам не распределяют, а выносят из системы в виде отдельной двухрядной таблицы. Особое положение в периодической системе занимает VIII группа; для элементов этой группы число валентных электронов может быть равно восьми (благородные газы, начиная с неона, железо, рутений и осмий), но может быть и больше восьми (например, у кобальта и никеля) или меньше восьми (гелий). Таким образом, VIII группа не укладывается в принятое определение группы и является таковой лишь формально.
Изменение свойств химических элементов в зависимости от положения в периодической системе.
Экспериментальными исследованиями была установлена зависимость химических и физических свойств элементов от их положения в периодической системе.
Электроотрицательность возрастает в направлении слева направо для элементов каждого периода и уменьшается в направлении сверху вниз для элементов одной и той же группы ПС.
Атомы и ионы не имеют строго определенных границ вследствие волновой природы электронов. Поэтому определяют условные радиусы атомов и ионов, связанных друг с другом химической связью в кристаллах.
Радиусы атомов металлов в периодах с ростом порядкового номера элементов уменьшаются, т. к. при одинаковом числе электронных слоев возрастает заряд ядра, а, следовательно, и притяжение им электронов.
В пределах каждой группы элементов, как правило, радиусы атомов увеличиваются сверху вниз, т. к. возрастает число энергетических уровней. Радиусы ионов также находятся в периодической зависимости от порядкового номера элемента.
По периоду справа налево увеличиваются неметаллические свойства атомов, за счет увеличения заряда ядра атома и трудности отдачи электронов. По подгруппе сверху вниз увеличиваются металлические свойства, т. к. ослабевает связь внешних электронов с ядром. По периоду справа налево увеличивается высшая степень окисления, равная номеру группы, поэтому увеличиваются неметаллические и кислотные свойства.
|
|
|
По подгруппе сверху вниз увеличиваются металлические и основные свойства, т. к. увеличивается размер атома и связь с соседним атомом ослабляется.
Определение и природа химической связи. Типы химической связи в зависимости от распределения электронной плотности.
Химической связью называют взаимодействие между атомами, приводящее к образованию молекул или ионов и прочному удерживанию атомов друг около друга.
Химическая связь имеет электронную природу, т. е. осуществляется за счёт взаимодействия валентных электронов. В зависимости от распределения валентных электронов в молекуле, различают следующие виды связей: ионная, ковалентная, металлическая и др. Ионную связь можно рассматривать как предельный случай ковалентной связи между атомами, резко отличающимися по природе.
|
|
|


