 |
Молярная концентрация С – это отношение количества растворенного вещества v (в молях) к объему раствора V в литрах.
|
|
|
|
Система Т-Ж: классификация. Растворы с жидкой дисперсионной средой. Природа растворов. Коллигативные свойства растворов. Законы Генри и Рауля. Осмотическое давление. Закон Вант-Гоффа. Качественные и количественные характеристики растворов.
Классификация по агрегатному состоянию. Наиболее общая классификация дисперсных систем основана на различии в агрегатном состоянии дисперсионной среди и дисперсной фазы. Сочетания трех видов агрегатного состояния позволяют выделить девять видов дисперсных систем. Для краткости записи их принято обозначать дробью, числитель которой указывает на дисперсную фазу, а знаменатель на дисперсионную среду, например для системы " газ в жидкости" принято обозначение Г/Ж
| Т/Ж | Твёрдая | Жидкая | Суспензии и золи: пульпа, ил, взвесь, паста |
Суспензии — дисперсные системы, в которых дисперсной фазой является твердое вещество, а дисперсионной средой — жидкость, — причем твердое вещество практически нерастворимо в жидкости. Чтобы приготовить суспензию, надо вещество измельчить до тонкого порошка, высыпать в жидкость, в которой вещество не растворяется, и хорошо взболтать (например, взбалтывание глины в воде). Со временем частички выпадут на дно сосуда. Этот процесс называется седиментацией. Очевидно, чем меньше частички, тем дольше будет сохраняться суспензия. Поэтому седиментационная неустойчивость тем выше, чем крупнее частицы.
Эмульсии — дисперсные системы, в которых и дисперсная фаза и дисперсионная среда являются жидкостями, взаимно не смешивающихся. Из воды и масла можно приготовить эмульсию длительным встряхиванием смеси. Примером эмульсии является молоко, в котором мелкие шарики жира плавают в жидкости. Суспензии и эмульсии — двухфазные системы.
|
|
|
Пены. Как и эмульсии, пены — грубодисперсные системы, Поэтому во многих технологических процессах пены получают теми же диспергационными методами, которые применяют для получения газовых пузырьков.
Аэрозоль – дисперсная система, состоящая из мелких, твёрдых или жидких частиц, взвешенных в газовой среде. Аэрозоли, дисперсная фаза которых состоит из капелек жидкости, называются туманами, а в случае твёрдой дисперсной фазы – дымами. Пыль относят к грубодисперсным аэрозолям.
раствор - это сложная, термодинамически устойчивая химическая система, образованная растворителем, растворенным веществом и продуктами их взаимодействия.
Основными компонентами раствора являются растворитель (дисперсионная среда) и растворенное вещество (дисперсная фаза). Это деление чисто условно. Если раствор образуется при смешивании компонентов одинакового агрегатного состояния, то растворителем считается компонент, которого в растворе больше. В остальных случаях растворителем обычно является жидкость или компонент агрегатное состояние которого не меняется при образовании раствора.
Коллигативными (общими) свойствами раствора являются те свойства, которые зависят от природы растворителя и концентрации растворенного вещества, но не зависят от свойств самого растворенного вещества. К ним относятся:
Относительное понижение давления насыщенного пара растворителя над раствором.
Увеличение температуры кипения раствора по сравнению с чистым растворителем.
Уменьшение температуры замерзания раствора по сравнению с чистым растворителем.
Осмотическое давление.
раствор - это сложная, термодинамически устойчивая химическая система, образованная растворителем, растворенным веществом и продуктами их взаимодействия.
Закон Генри - растворимость газов постоянной температуре пропорциональна давлению. См=P/RT-для не электролитов. Если будет электролит¸ то: См=P/RT *I i-изотон. коэффициент (учитывает степень диссоциации); L(альфа)=i-1/n-1 L-степень диссоциации
|
|
|
Законы Рауля: 1й. относительное понижение давления пара растворителя над раствором пропорционально мольной доле растворенного вещества. P0-P/P0=n давление водяных паров- табличное значение. 2й. понижение температуры замерзания или повышение температуры кипения пропорционально моляльной концентрации раствора 1. Δ tзамер=Кфиоскип. *См=mчис. в-ва *1000*Kкри. /M*mрастворителя; 2. Δ tкип=К эбулиоскопическая *См=mч. в-ва*1000*Kэбул. /M*m растворителя. К криоск. И К эбул. Не зависит от природы вещества, а зависит от природы расворителя. Это табличная величина.
| К эбул. | К криоск. | |
| вода | 0. 516 | 1. 86 |
| бензол | 2. 57 | 5. 12 |
| CH3COOH | 3. 1 | 3. 9 |
А если электролит, то: 1 *i 2*i
Tкип=100+Δ t кип. Для воды
Tзамерз. =0-Δ tзамерз. Для воды
Осмос-односторонняя диффузия через полупронецаемую перегородку. Условия: раствор, растворитель и полупроницаемая перегородка. Pосм=pgh (g=9. 81 м/с^2)
Закон Вант-Гоффа: осмотическое давление разбавляемых растворов пропорционально молярной концентрации и температуре. Pосм= СмRT; если электролит, то: Росм=СмRT*i
Для качественной характеристики растворов используют понятия «разбавленный раствор» (содержит мало растворенного вещества) и «концентрированный раствор» (содержит много растворенного вещества).
При работе с растворами необходимо знать их количественный состав. Количественный состав растворов выражается различными способами. Мы изучим два способа: а) массовая доля растворенного вещества; б) молярная концентрация (молярность).
Массовая доля растворённого вещества -это отношение массы растворённого вещества к массе раствора.

Для расчёта процентной концентрации используется формула:
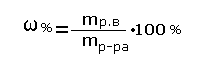
Массовая доля растворённого вещества wрастворённого вещества - это безразмерная величина, равная отношению массы растворённого вещества mрастворённого вещества к общей массе раствора mраствора:
mраствора = mрастворённого вещества + mрастворителя
Массовую долю растворённого вещества (процентная концентрация) обычно выражают в долях единицы или в процентах. Например, массовая доля растворённого вещества – CaCl2 в воде равна 0, 06 или 6%. Это означает, что в растворе хлорида кальция массой 100 г содержится хлорид кальция массой 6 г и вода массой 94 г.
|
|
|

Молярная концентрация С – это отношение количества растворенного вещества v (в молях) к объему раствора V в литрах.
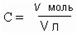
|
|
|


