 |
14. Энтропия, определение энтропии (вероятное, энергетическое, техническое). Энтропия процесса, стандартная энтропия.
|
|
|
|
14. Энтропия, определение энтропии (вероятное, энергетическое, техническое). Энтропия процесса, стандартная энтропия.
Стандартная энтропия вещества – абсолютное значение энтропии вещества при стандартных условиях в любом данном агрегатном состоянии.
Расчет Δ S
Δ S 0реакции= ∑ ν n Δ S 0продуктов - ∑ ν n Δ S 0исходных веществ
Выводы:
1) Измерение S характеризует стремление сист к наиболее вероятному состоянию с наибольшим беспорядком (с наиб S)
2) Изменение S не является однозначным критерием возможности самопроизвольного протекания процесса.
Несамопроизвольными процессами называются те, для совершения которых требуется затрата работы извне.
Несамопроизвольный процесс приводит к уменьшению порядка в системе и характеризуется уменьшением S.
S< 0 – несамопроизвольный процесс
Самопроизвольными процессами называют процессы, которые могут протекать без затраты работы извне (обмен, нейтрализация).
Самопроизвольный процесс приводит к увеличению порядка в системе и характеризуется увеличением S.
S> 0 – самопроизвольный процесс
Абсолютная энтропия (S) вещества или процесса – это изменение доступной энергии при теплопередаче при данной температуре (Btu/R, Дж/К).
Удельную энтропию (S ) измеряют относительно единицы массы вещества. Температурные единицы, которые используются при вычислении разниц энтропии состояний, часто приводятся с температурными единицами в градусах по Фаренгейту или Цельсию.
Энтропия характеризует структуру системы с точки зрения распределения энергии в объёме внутри и вокруг системы, отражая меру связи и взаимодействия частиц системы. Энтропия получается пропорциональной отношению упорядоченной (структурной, потенциальной) энергии, обеспечивающей целостность и неизменность системы, к хаотической энергии теплового движения частиц. Под упорядоченной энергией подразумевается энергия направленного движения вещества, энергия сжатия от давления и потенциальная энергия вещества в гравитационном и электромагнитных полях.
|
|
|
Отношение общего количества теплоты ∆ Q к величине абсолютной температуры Т назвал изменением энтропии. 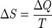
15. Второй закон термодинамики. Энергия Гиббса. Стандартная энергия Гиббса образования. Изменение энергии Гиббса.
В системе при постоянной температуре и давлении самопроизвольно могут совершаться только такие процессы, в результате которых энергия Гиббса уменьшается, т. е. Δ Gкон > Δ Gнач, или Δ G < 0.
На основе этого сформулирован второй закон термодинамики для изолированных систем.
В изолированных системах самопроизвольно могут совершаться возрастает, т. е.  S > 0.
энергия Гиббса G:
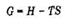
|
Энергия Гиббса является обобщенной термодинамической функцией состояния системы, учитывающей энергетику и неупорядоченность системы при изобарно-изотермических условиях.
Энергию Гиббса называют также изобарно-изотермическим потенциалом или свободной энергией.
Подобно другим термодинамическим параметрам и функциям, характеризующим состояние системы, изменение энергии Гиббса в результате любого процесса определяется только конечным и начальным состоянием системы, независимо от пути процесса:
Для полной энергетической характеристики вещества при стандартных условиях используют стандартную энергию Гиббса образования вещества 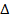 G0, значение которой дано в справочной литературе. Для простых веществ в термодинамически устойчивой форме стандартная энергия Гиббса их образования условно принята равной нулю.
G0, значение которой дано в справочной литературе. Для простых веществ в термодинамически устойчивой форме стандартная энергия Гиббса их образования условно принята равной нулю.
|
|
|
В химических процессах одновременно действуют два противоположных фактора — энтропийный. Суммарный эффект этих противоположных факторов в процессах, протекающих при постоянном давлении и температуре, определяет изменение энергии.
Характер изменения энергии Гиббса позволяет судить о принципиальной возможности осуществления процесса. При процессе может протекать — самопроизвольный процесс, при процессе протекать не может — не самопроизвольный процесс (иными словами, если энергия Гиббса в исходном состоянии системы больше, чем в конечном, то процесс принципиально может протекать, если наоборот — то не может). Если же то система находится в состоянии химического равновесия.
|
|
|


