 |
52. Природа растворов. Коллигативные свойства растворов.
|
|
|
|
52. Природа растворов. Коллигативные свойства растворов.
Коллигативными (общими) свойствами раствора являются те свойства, которые зависят от природы растворителя и концентрации растворенного вещества, но не зависят от свойств самого растворенного вещества. К ним относятся:
Относительное понижение давления насыщенного пара растворителя над раствором.
Увеличение температуры кипения раствора по сравнению с чистым растворителем.
Уменьшение температуры замерзания раствора по сравнению с чистым растворителем.
Осмотическое давление.
раствор - это сложная, термодинамически устойчивая химическая система, образованная растворителем, растворенным веществом и продуктами их взаимодействия.
53. Законы Генри и Рауля. Осмотическое давление. Закон Вант-Гоффа.
Закон Рауля:
Относительное понижение давления насыщенного пара растворителя над раствором равно молярной доле растворенного вещества.
закон Генри:
Масса газа, растворяющегося при постоянной температуре в данном объёме жидкости, прямо пропорциональна парциальному давлению газа.
Осмотическое давление – это такое давление, которое нужно приложить к раствору, отделенному от растворителя полупроницаемой перегородкой, чтобы наступило состояние равновесия (прекратился осмос).
Осмос – самопроизвольный переход растворителя через полупроницаемую мембрану, разделяющую раствор и растворитель или два раствора с различной концентрацией растворенного вещества. Осмос обусловлен диффузией молекул растворителя через полупроницаемую перегородку, которая пропускает только молекулы растворителя.
Закон Вант-Гоффа: Для разбавл. растворов осмотическое давление независимо от рода р-теля и р-ного в-ва при данной температуре пропорциональна молярной концентрации р-ра. Используя осмитич. Давление также можно определить молек. массы р-ных в-в. Pосм=CmRT=nRT/Vр-ра=mр/мр/Vр-ра
|
|
|
54. Качественные и количественные характеристики растворов.
Для качественной характеристики растворов используют понятия «разбавленный раствор» (содержит мало растворенного вещества) и «концентрированный раствор» (содержит много растворенного вещества).
При работе с растворами необходимо знать их количественный состав. Количественный состав растворов выражается различными способами. Мы изучим два способа: а) массовая доля растворенного вещества; б) молярная концентрация (молярность).
Массовая доля растворённого вещества -это отношение массы растворённого вещества к массе раствора.
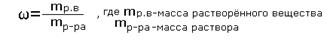
Для расчёта процентной концентрации используется формула:

Массовая доля растворённого вещества wрастворённого вещества - это безразмерная величина, равная отношению массы растворённого вещества mрастворённого вещества к общей массе раствора mраствора:
mраствора = mрастворённого вещества + mрастворителя
Массовую долю растворённого вещества (процентная концентрация) обычно выражают в долях единицы или в процентах. Например, массовая доля растворённого вещества – CaCl2 в воде равна 0, 06 или 6%. Это означает, что в растворе хлорида кальция массой 100 г содержится хлорид кальция массой 6 г и вода массой 94 г.

Молярная концентрация С – это отношение количества растворенного вещества v (в молях) к объему раствора V в литрах.
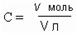
|
|
|


