 |
4.2. Законы электролиза. 5. Химические источники тока
|
|
|
|
4. 2. Законы электролиза
Количественная характеристика электролиза выражается двумя законами Фарадея:
1. Масса вещества, выделяющегося на электродах, прямо пропорциональна количеству прошедшего через электролит электричества
m = КэQ = КэI · t, где
m – масса выделившегося вещества, Q – количество электричества (Кл), I – сила тока (А), t – время (с), Кэ – электрохимический эквивалент вещества, выделившегося на электродах при протекании тока силой в 1 А в течение 1 сек (или количеством электричества в 1 Кл).
2. При электролизе различных электролитов равные количества электричества выделяют на электродах массы веществ, пропорциональные молярным массам их эквивалентов.
Кэ =  m =
m = 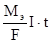 , где
, где
F – число Фарадея, Мэ – молярная масса эквивалента. Если I · t = F = 96500 Кл, то m = Мэ. Для химического превращения молярной массы эквивалента любого вещества необходимо пропустить через электролит количество электричества, равное числу Фарадея (96500 Кл).
На законах Фарадея основан один из точных способов измерения количества электричества, прошедшего в системе. Для этого служат приборы, называемые кулонометрами.
Вследствие параллельных побочных процессов масса вещества, получаемого при электролизе, оказывается часто меньше той, которая соответствует количеству прошедшего электричества. Отношение массы реально выделенного вещества на электроде к теоретической и умноженное на 100% называют выходом по току:
η э = 
5. Химические источники тока
Любой гальванический элемент может быть источником постоянного тока. Но лишь немногие из них удовлетворяют техническим требованиям, делающим возможным их использование.
|
|
|
В основе некоторых современных сухих батарей, питающих слуховые аппараты, карманные фонари, переносную аппаратуру связи, лежит схема элемента Лекланше, предложенная в 1876 г.:
Zn/NH4Cl/MnO2. Удобство такого портативного источника тока заключается в том, все его составные части представляют собой твердые или пастообразные вещества, упаковка которых предотвращает их попадание на окружающие предметы. Анодом сухого элемента служит его цинковая оболочка, а катодом – графитовый стержень, спрессованный в слой оксида марганца (IV) и углерода. В качестве электролита используется паста из хлорида цинка, хлорида амония и воды. На электродах сухого элемента протекают следующие полуреакции.
На аноде: Zn(тв) → Znag2+ + 2e-
На катоде: 2MnO2(тв) + 2NH4+ + 2e- → Mn2O3(тв) + 2NH3 + H2O
Суммарная реакция описывается уравнением:
Zn + 2MnO2 + 2NH4Cl → [Zn(NH3)2]Cl2 + Mn2O3 + H2O
Напряжение такого элемента – 1, 5 В. Сухие элементы представляют собой первичные химические источники тока (или гальванический элемент одноразового действия). После разрядки сухой элемент использовать нельзя и его приходится выбрасывать.
Вторичным источником тока являются аккумуляторы. Работоспособность разряженного аккумулятора можно восстановить, зарядив его, т. е. пропустив через него в обратном направлении ток от внешнего источника (электролиз). При зарядке аккумулятор работает как электролизер, а при разрядке – как гальванический элемент. Процессы заряда аккумуляторов осуществляются многократно. В таблице 3 приведены характеристики наиболее распространенных гальванических элементов.
Наиболее распространенным является свинцовый (кислотный) аккумулятор. Свинцовый аккумулятор представляет собой систему свинцовых перфорированных пластин, заполненных губчатым свинцом и являющихся катодом, а положительным электродом служит оксид свинца PbO2, впрессованный в свинцовую решетку. В качестве электролита используется 30%-ный раствор серной кислоты. Схема аккумулятора:
|
|
|
Pb ׀ H2SO4 ׀ PbO2
При погружении пластины в серную кислоту на их поверхности образуется труднорастворимая соль-сульфат свинца PbSO4. В этом состоянии электроды имеют одинаковый химический состав и окислительно-восстановительное взаимодействие невозможно, аккумулятор разряжен. Поэтому предварительно проводят зарядку аккумулятора, пропуская через него постоянный электрический ток от внешнего источника. Процессы, протекающие при зарядке подобны процессам при электролизе.
На катоде (-) происходит процесс восстановления.
Pb2+ + 2e- = Pb0 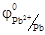 = -0, 36 В
= -0, 36 В
Этой реакции разряда соответствует электрохимическая реакция:
PbSO4 + 2H+ + 2e → Pb0 + H2SO4
На аноде (+) ионы Pb2+ окисляются.
Pb2+ - 2е → Pb+4 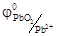
PbSO4 – 2е + SO42- → Pb(SO4)2
Образующаяся соль подвергается гидролизу
Pb(SO4)2 + 4H2О → Pb(ОН)4 + H2SO4
с последующим разложением Pb(ОН)4 = PbО2 + 2H2О, т. е. конечным результатом является образование оксида свинца (IV) - PbО2.
Таким образом, после зарядки один электрод аккумулятора представляет собой губчатый металлический свинец, а другой – оксид свинца (IV).
Общее химическое уравнение процесса зарядки:
PbSO4 + 2H2О → Pb + PbO2 + 2H2SO4
При работе аккумулятора (разрядке) процессы на электродах протекают в обратном направлении.
Окисление на аноде:
Pb – 2е + SO42-→ PbSO4
Восстановление на катоде:
PbO2 + 4Н+ + SO42- + 2е → PbSO4 + 2H2О
Суммарная реакция
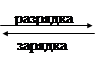 |
PbO2 + Pb + 2H2SO4 2PbSO4 + 2H2О
В процессе зарядки концентрация кислоты увеличивается, а в процессе разрядки наоборот, уменьшается. Относительная плотность серной кислоты указывает насколько разряжен аккумулятор. ЭДС свинцового аккумулятора достигает 2, 1 В.
Напряжение при заряде выше ЭДС и растет в течение заряда. В конце напряжение достигает значения, достаточного для электролиза воды, тогда начинается выделение водорода и кислорода, поэтому выделение пузырьков газа (кипение) служит признаком окончания заряда аккумулятора.
При разрядке аккумулятора его ЭДС и напряжение падают. Если напряжение упадет ниже 1, 7 В, на электродах начинается образование пленки PbSO4 особой кристаллической структуры (так называемое сульфатирование), которая изолирует электроды от электролита. Вследствие этого недопустимо снижение напряжения до 1, 7 В.
|
|
|
Свинцовый аккумулятор обладает высоким КПД (≈ 80%), высокой ЭДС, простотой и невысокой ценой. Недостатки – небольшая удельная энергия ≈ 20-30 Вт∙ ч/кг и малый срок службы (от 2 до 5 лет).
|
|
|


