 |
6.1. Химическая коррозия. 6.2. Электрохимическая коррозия
|
|
|
|
6. 1. Химическая коррозия
Химическая коррозия обусловлена взаимодействием металла с сухими газами или жидкостями, не проводящими электрического тока. Химической коррозии подвергаются детали и узлы машин, работающих в атмосфере кислорода, галогенов, при высоких температурах (турбинные, ракетные двигатели, оборудование химических производств).
Механизм реакции сравнительно прост. Продукты реакции образуются на тех участках металлической поверхности, которые вступили в реакцию. Так, на железе при 250-300оС появляется видимая пленка оксидов, при 600оС и выше поверхность металла покрывается слоем окалины, состоящей из оксидов железа различной степени окисления (FeO, Fe3O4, Fe2O3). Окалина не может защитить металл от дальнейшего окисления, так как содержит трещины и поры, которые позволяют проникать кислороду к металлу. При повышении температуры свыше 800оС скорость окисления железа резко увеличивается.
Образующиеся на металле оксидные пленки часто препятствуют дальнейшему окислению (образуется так называемая «защитная» пленка, которая препятствует проникновению к металлу как газов, так и жидкостей). Защитными свойствами обладает только та пленка, которая может покрывать сплошь весь металл. Расчеты показывают, что это возможно, если объем оксида металла больше объема самого металла, пошедшего на образование этого оксида:
Vокс/Vме> 1
Для щелочных и щелочно-земельных металлов это условие не соблюдается (Vокс/Vме< 1). Такие пленки защитными свойствами не обладают и эти металла ввиду своей химической активности принадлежат к числу коррозионно нестойких. На алюминии и хроме образуются хорошие защитные пленки, благодаря чему металлы в атмосферных условиях коррозийно стойки (хотя химически активны). Толщина таких пленок крайне мала, например, на алюминии она достигает только 100 Å. Такие пленки состоят всего из нескольких слоев молекул и могут быть обнаружены только специальными оптическими методами.
|
|
|
Если металл, покрытый пленкой, продолжает корродировать, то это означает, что имеет место диффузия атомов кислорода сквозь пленку к металлу, а атомов металла – в обратном направлении. Диффузия металла и кислорода в слое твердого защитного оксида может происходить по одному из двух возможных механизмов:
а) движение ионов в междоузельном пространстве кристаллической решетки;
б) движение ионов по пустым узлам решетки.
Первый механизм имеет место при образовании пленок ZnO, CdO, BeO, Al2O3; второй – Cu2O, FeO, NiO, CoO, ZrO2, TiO2.
Диффузия катионов в защитной пленке сопровождается одновременным перемещением в том же направлении эквивалентного числа электронов в междоузлиях при первом механизме и по «электронным дефектам» (катионом с более высокой валентностью) при втором механизме. При повышении температуры окисление металлов на воздухе происходит более интенсивно (увеличивается скорость диффузии).
6. 2. Электрохимическая коррозия
Разрушение металла при соприкосновении с электролитом с возникновением в системе электрического тока называется электрохимической коррозией.
В атмосферных условиях роль электролита играет водная пленка на металлической поверхности, в которых часто растворены электропроводящие примеси. Электродами обычно являются сам металл и примеси в нем содержащиеся. В качестве примера рассмотрим действие серной кислоты на железо, содержащего примесь меди. При таком контакте возникает множество микроскопических гальванических элементов.
(-) Fe ׀ H2SO4 ׀ Cu(+) 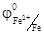 = - 0, 44 В
= - 0, 44 В 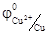 = 0, 34 В
= 0, 34 В
|
|
|
Более активный металл-железо – окисляется, посылая электроны атомам меди и переходит в раствор в виде ионов Fe2+, а ионы водорода разряжаются (восстанавливаются) на меди.
Помимо этого железо может растворяться и при непосредственном взаимодействием с кислотой (Fe + 2Н+ = Fe2+ + Н2↑ ), но опыт показывает, что скорость этой реакции мала по сравнению со скоростью растворения железа как анода гальванопары. Механизм коррозии в кислой и нетральной среде различен.
Рассмотрим коррозию технического железа на воздухе, когда оно покрыто влажной пленкой или находится в растворе электролитов с небольшой концентрацией гидроксид ионов. В качестве анода здесь служит основной металл – железо, катодом, являются примеси содержащиеся в металле, например, зерна графита:
Анод: Fe – 2e- = Fe2+
Катод: 2H2O + O2 + 4e- = 4OH-
Ионы OH- соединяются с перешедшими в раствор ионами Fe2+
Fe2+ + 2OH- = Fe(ОН)2
4Fe(ОН)2 + O2 + 2H2O = 4Fe(ОН)3
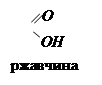 |
Fe(ОН)3 = Fe + H2O
Согласно теории электрохимической коррозии при соприкосновении металла с электролитом на его поверхности возникает множество микрогальванических элементов. При этом анодами являются частицы металлов, катодами – загрязнения, примеси и участки металла, имеющие более положительный потенциал. Механическая обработка изменяет электродный потенциал, поэтому соприкосновение двух участков металла деформированного и недеформированного достаточно для появления разности потенциалов. Корродировать будет деформированный участок. Разность потенциалов возникает и там где соприкасаются обнаженный и покрытый пленкой участки.
Поскольку ионы и молекулы, связывающие электроны в катодном процессе, называют деполяризаторами, то часто говорят о водородной деполяризации в кислой и кислородной деполяризации в нейтральной и скабощелочной средах.
Поскольку электрохимическая коррозия обусловлена деятельностью гальванических элементов, можно сделать вывод, что факторы способствующие деятельности гальванических элементов усиливают коррозию. Скорость коррозии тем больше, чем дальше отстоят в ряду напряжений металлы, из которых образовалась гальваническая пара. Скорость коррозии возрастает с ростом температуры и с увеличением концентрации окислителя в растворе.
|
|
|
Нередко продукты коррозии оказываются малорастворимыми в данной среде и своим присутствием защищают металл от дальнейшего разрушения. Например, железо в щелочных растворах, свинец в разбавленной серной кислоте коррозионно стойки вследствие образования пленок Fe(OH)2, PbSO4.
Большое значение в процессах коррозии имеют поляризация электродов, образование пленок на металлах, пернапряжение водорода. Если бы в коррозионных процессах не происходило поляризации электродов (см. поляризация), то процессы коррозии протекали бы с такой скоростью, что железо и ряд других металлов потеряли бы свое значение в технике.
|
|
|


