 |
Величина отрицательной степени окисления равна числу электронов, недостающих до завершения внешнего электронного слоя их атомов.
|
|
|
|
При составлении химических формул бинарных соединений неметаллов (т.е. образованных атомами только двух элементов) принято первым записывать символ менее электроотрицательного элемента, проявляющего в этом веществе положительную степень окисления. На второе место ставится символ более электроотрицательного элемента, например: 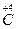
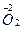 ;
; 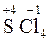 ;
; 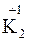
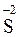 и т.д. Исключение составляют соединения неметаллов с водородом, водные растворы которых не проявляют кислотных свойств:
и т.д. Исключение составляют соединения неметаллов с водородом, водные растворы которых не проявляют кислотных свойств: 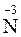
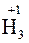 ;
; 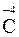
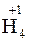 ;
; 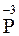
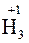 .
.
Согласно нормам современной номенклатуры в названиях бинарных соединений неметаллов принято называть элемент, который проявляет в них отрицательную степень окисления, с добавлением окончания -ид (причем могут использовать как латинское название элемента, так и русское). Например, соединения кислорода с менее электроотрицательными элементами называются оксиды (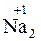
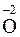 – натрий-оксид); соединения азота с менее электроотрицательными элементами – нитриды (
– натрий-оксид); соединения азота с менее электроотрицательными элементами – нитриды (
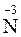 - натрий-нитрид); соединения фосфора с менее электроотрицательными элементами – фосфиды (
- натрий-нитрид); соединения фосфора с менее электроотрицательными элементами – фосфиды (
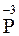 – натрий-фосфид).
– натрий-фосфид).
С кислородом неметаллы образуют, главным образом, кислотные оксиды общего вида 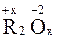 . Некоторые из неметаллов, находясь в своей низшей положительной степени окисления, образуют несолеобразующие оксиды (CO, N2O, SiO).
. Некоторые из неметаллов, находясь в своей низшей положительной степени окисления, образуют несолеобразующие оксиды (CO, N2O, SiO).
При растворении кислотных оксидов (кроме SiO2) в Н2О получается соответствующая кислородсодержащая кислота.
Из нескольких кислородсодержащих кислот одного неметалла сильнее та, в которой он проявляет бóльшую положительную степень окисления.
С водородом неметаллы образуют летучие водородные соединения общего вида 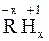 , молекулы которых образованы полярной (HCl, H2O, H2S, NH3) или малополярной (CH4, SiH4) ковалентной связью.
, молекулы которых образованы полярной (HCl, H2O, H2S, NH3) или малополярной (CH4, SiH4) ковалентной связью.
|
|
|
Водородные соединения неметаллов VIIА и VIА групп в водном растворе проявляют кислотные свойства. Растворы водородных соединений других неметаллов кислотными свойствами не обладают.
Раствор NH3 проявляет оснóвные свойства за счет образования слабого основания NH3 · Н2O.
Простые вещества, образованные неметаллами, как правило, являются газами или твердыми веществами (исключение составляет Br2, которое является жидкостью).
Молекулы газообразных веществ – двухатомные, кроме озона (O3), и благородных газов (их молекулы одноатомные).
Простые твердые вещества чаще всего имеют атомную кристаллическую решетку или, в некоторых случаях, – молекулярную: белый фосфор (Р4), ромбическая и моноклинная сера (S8), кристаллический иод (I2).
Общая характеристика элементов VIIА группы
Нахождение в природе
В VII А группу входят следующие элементы: фтор F, хлор CI, бром Br, иод І, астат At, – которые носят общее название галогены, что буквально означает: солерождающие. Они являются неметаллами и принадлежат к семейству р-элементов.
Галогены (кроме астата) широко встречаются в природе. Астат же получают, главным образом, искусственным путем. Общее содержание астата в слое земной коры толщиной 1,6 км оценивается в ≈ 70 мг. Он радиоактивен (период полураспада самого устойчивого изотопа равен 8,1 часа), мало изучен.
Галогены в природе в свободном виде не встречаются и существуют только в связанном виде, т.е. в виде соединений с другими элементами. Наиболее распространены в природе хлор и фтор, их содержание в земной коре составляет 0,19% и 0,03% по массе, соответственно.
Соединения хлора и фтора в виде различных минералов образуют на суше самостоятельные месторождения. Для хлора важнейшими природными минералами являются каменная соль NaCl, карналлит KCl ∙ MgCl2 ∙ 6 H2O, сильвинит KCl ∙ NaCl. Наиболее известными минералами фтора являются флюорит или плавиковый шпат CaF2, криолит Na3AlF6, фторапатит Ca5(PO4)3F.
|
|
|
Бром и иод являются рассеянными элементами, месторождений своих минералов не образуют. В значительных количествах бром и иод, наряду с остальными галогенами, в виде различных солей содержатся в морской воде, откуда они активно усваиваются водорослями.
|
|
|


