 |
Vi. Устройство кристаллизаторов
|
|
|
|
Кристаллизаторы по принципу действия делятся на аппараты периодического и непрерывного действия с отгонкой части растворителя и с охлаждением раствора. Как уже было сказано, кристаллизация с частичной отгонкой воды осуществляется в вакуум-аппаратах. Интересной разновидностью являются кристаллизаторы с псевдоожиженным слоем.
|
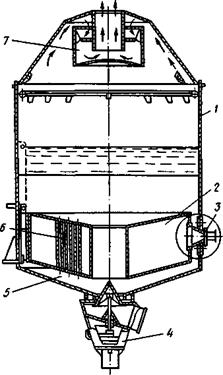
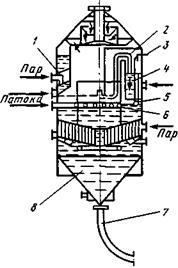
Вакуум-аппарат с естественной циркуляцией периодического действия с подвесной греющей камерой показан на рис. 3. Греющая камера состоит из двух конических трубчатых решеток, в которых развальцованы греющие трубы. По оси греющей камеры расположена циркуляционная труба. Между корпусом греющей камеры и стенками аппарата имеется кольцевое пространство, в котором циркулирует утфель.
В вакуум-аппаратах применяют специальное устройство для подвода пара в греющую камеру, которое воспринимает температурные деформации, возникающие при расширении греющей камеры и корпуса аппарата, и обеспечивает герметичность. Это устройство представляет собой конический патрубок, жестко соединенный с греющей камерой; с корпусом аппарата он соединен при помощи мембраны, воспринимающей температурные деформации.
Рис. 3. Вакуум-аппарат с подвесной греющей камерой: 1 — корпус; 2 — греющая камера; 3 - устройство для ввода пара; 4 — циркуляционная труба; 5 — днище; 6 — греющая труба; 7 — сепаратор инерционного типа
Для улучшения циркуляции утфеля используют способ вдувания пара в нижнюю часть греющей камеры. Для этого под основной греющей камерой встраивают дополнительную греющую камеру с отверстиями для выхода пара. Пар, выходящий из трубок, поступает в греющие трубы основной камеры с большой скоростью, дробится на мелкие пузырьки и смешивается с утфелем, интенсифицируя тем самым циркуляцию.
|
|
|
Греющие камеры вакуум-аппаратов, применяемых в сахарном производстве, могут иметь различную конструкцию.
Распространение получили вакуум-аппараты с подвесными греющими камерами, верхние и нижние решетки которых выполняются коническими, сферическими, двускатными и др. Пар поступает в межтрубчатое пространство греющих камер, а увариваемый продукт перемещается внутри труб.
Диаметр греющей камеры в большинстве конструкций вакуум-аппаратов меньше диаметра корпуса аппарата. Между стенками греющей камеры и корпусом вакуум-аппарата образуется кольцевое пространство, по которому циркулирует утфель.
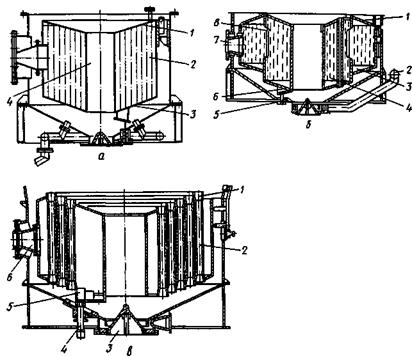
На рис. 5 показаны конструкции наиболее распространенных в сахарной промышленности греющих камер вакуум-аппаратов.
Сепарирующие устройства в вакуум-аппаратах, как и в выпарных аппаратах, предназначены для отделения от вторичного пара капель продукта. В вакуум-аппаратах продукт имеет большую вязкость, поэтому используются сепараторы инерционного типа, которые устанавливают над утфельным пространством в верхней части корпуса аппарата. К нижней части корпуса аппарата приваривают днище со спускным устройством для утфеля с гидравлическим и механическим управлением. Лучшими являются устройства клапанного типа.
Кристаллизаторы непрерывного действия состоят из концентратора, кристаллогенератора и камеры роста кристаллов. Конструкция аппарата должна обеспечивать интенсивную циркуляцию, препятствующую осаждению кристаллов в аппарате, улучшающую теплопередачу и обеспечивающую получение равномерных по величине кристаллов.
На рис. 6 представлен вакуумный кристаллизатор непрерывного действия, применяемый в сахарном производстве. Концентратор и кристаллогенератор выполнены в виде кольцевых сегментов с трубчатой поверхностью нагрева. Концентратор герметически отделен от других узлов аппарата, что позволяет создавать в нем избыточное давление, не зависимое от давления в других частях аппарата. Кристаллогенератор верхней открытой частью соединен с надутфельным пространством камеры роста кристаллов. Камера роста кристаллов выполнена в виде цилиндра, снабженного типовой поверхностью нагрева. При помощи цилиндрической и радиальных перегородок она разделена на четыре секции.
|
|
|
При установившемся режиме патока поступает в концентратор и в камеру роста кристаллов. В концентраторе при повышении давления патока сгущается при температуре, превышающей температуру кристаллообразования на 10...15 °С, поступает в кристаллогенератор, где она вскипает. При этом удаляется часть растворителя и снижается температура, что приводит к резкому росту коэффициента пересыщения. При циркуляции патоки происходит интенсивное образование кристаллов. Содержание кристаллов регулируется величиной перегрева патоки в концентраторе и количеством подаваемого в кристаллогенератор пара.
Утфель, полученный в кристаллогенераторе, Непрерывно поступает в первую секцию камеры роста кристаллов, куда также непрерывно поступает патока. Утфель перетекает из первой секции в четвертую, уваривается и через выгрузочное устройство непрерывно удаляется из аппарата. Управление работой аппарата осуществляется автоматически.
Простейшие кристаллизаторы периодического действия — вертикальные цилиндрические аппараты со змеевиками и механическими мешалками. Процесс кристаллизации в них ведется одновременно с охлаждением раствора.
В пищевой технологии применяют в основном два типа кристаллизаторов: корытного типа и вращающиеся барабанные.
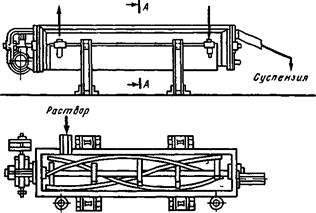
На рис. 4 показан кристаллизатор корытного типа с ленточной мешалкой. Вместо ленточной мешалки может использоваться шнековая мешалка, которая выполнена в виде бесконечного винта. Средний размер кристаллов в таких кристаллизаторах не превышает 0,5....0,6 мм.
Кристаллизаторы корытного типа довольно широко распространены в промышленности. Они просты в обслуживании и надежны в работе.
|
|
|
Барабанные кристаллизаторы бывают с водяным и воздушным охлаждением. При воздушном охлаждении кристаллы получаются более крупными из-за низкого коэффициента теплоотдачи от раствора к воздуху, но при этом производительность кристаллизатора значительно ниже, чем при водяном охлаждении.
|
Барабанный кристаллизатор представляет собой вращающийся цилиндрический барабан, наклоненный по ходу раствора к горизонту (рис. 7). Раствор поступает с верхнего конца барабана, а кристаллы выгружаются с нижнего конца. При вращении барабана кристаллизатора раствор смачивает стенки, увеличивая тем самым площадь поверхности испарения воды.
|
| А-А |
Рис. 4. Кристаллизатор с ленточной мешалкой: 1 — корытообразный корпус; 2 — водяная рубашка; 3 — мешалка
|
Рис. 5. Схемы греющих камер вакуум-аппаратов: а — с коническими трубными решетками (1 — верхняя трубная решетка; 2 — греющая труба; 3 — нижняя трубная решетка; 4 — циркуляционная труба); 6 — конической двускатной формы (7 — трубная решетка; 2 — труба для ввода продукта; 3 — наружная часть греющей камеры; 4 — внутренняя часть греющей камеры; 5 — труба для отвода конденсата; 6 — карман для конденсата; 7,— штуцер для подвода пара; 8 — окно); в — без трубных решеток (/ — надставка; 2 — средняя часть греющей камеры; 3 — устройство для спуска утфеля; 4 — труба для отвода конденсата; 5 — карман; 6 — штуцер для подвода пара)
|
Рис. 6. Кристаллизатор непрерывного действия:

|
| Раствор |
| А-А |
I — концентратор; 2 — труба; 3 — штурвал для регулирования положения трубы; 4 — кристаллогенератор; 5 — сливная труба; 6 — барботер; 7 — выгрузочное устройство; 8 — камера роста кристаллов
| Суспензия |
Рис. 7. Барабанный кристаллизатор: 1 — кожух; 2 — барабан; 3 — приемник суспензии; 4 — ролик; 5 — змеевик; 6 — воронка
Барабан заключен в кожух, в который подаются охлаждающая вода либо воздух.
Теплоноситель движется в кожухе противотоком к раствору. Расход охлаждающей воды составляет примерно 5 м3 на 1 м3 раствора. Для предотвращения образования кристаллов на стенках в некоторых конструкциях предусмотрен обогрев нижней части барабана. Для этого в кожухе прокладывают обогревательные трубы.
|
|
|
Кристаллизаторы с псевдоожиженным слоем позволяют интенсифицировать процесс. Кристаллизация может проводиться как с удалением части растворителя путем его испарения, так и при охлаждении раствора.
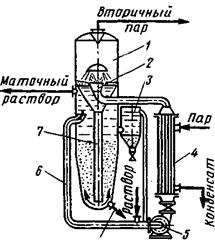
Схема кристаллизатора приведена на рис. 8. Исходный раствор смешивается в циркуляционной трубе с циркулирующим маточным раствором, смесь нагревается в теплообменнике и поступает через трубу вскипания в аппарат, где происходит интенсивное парообразование. Пересыщенный раствор опускается в нижнюю часть кристаллизатора. Здесь в результате циркуляции раствора создается псевдоожиженный слой. Образовавшиеся крупные кристаллы (до 2 мм) оседают на дно и выводятся из аппарата, а мелкие продолжают расти либо удаляются через сборник 3.
При интенсивном перемешивании суспензии в псевдоожиженном слое увеличивается скорость диффузии вещества в растворе и ускоряется процесс роста кристаллов. При этом уменьшается степень пересыщения раствора и скорость роста кристаллов оказывается
|
большей, чем скорость образования центров кристаллизации. При кристаллизации в псевдоожиженном слое получают кристаллы более узкого фракционного состава, чем при других методах.
Рис. 8. Кристаллизатор с псевдоожиженным слоем:
1 — корпус; 2 — труба вскипания; 3— сборник; 4 — теплообменник; 5 — насос; 6 — циркуляционная труба; 7 — центральная труба
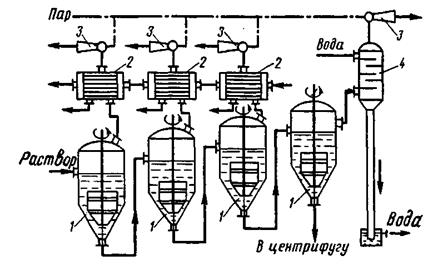
Рис. 9. Многокорпусная вакуум-кристаллизационная установка: 1 - вакуум-кристаллизаторы; 2 — поверхностные конденсаторы; 3 — пароструйный насос; 4 — барометрический конденсатор.
Процесс экстракции.
Процесс экстракции (извлечение) ценных веществ, входящих в состав сложного твердого тела чаще всего пористой структуры и органического происхождения, играет важную роль во многих технологических процессах различных отраслей пищевой промышленности: гидролизной, масло – жировой, сахарной, ферментной и т.д.
Процесс экстракции происходит в результате непрерывного движения молекул растворителя и растворенного вещества. Чем выше температура, тем интенсивнее это движение и тем скорее произойдет выравнивание концентрации во всех точках объема, занимаемого раствором. Поэтому процесс экстракции стремятся вести при возможно более высокой температуре, которая в общем случае лимитируется технологическими соображениями.
Для большей эффективности процесса важно иметь измельченное сырье, так как в этом случае увеличивается удельная (отнесенная к единице массы сырья) активная поверхность. Однако степень измельчения ограничивается гидродинамическими условиями, создающимися в том или ином аппарате. Очень маленькие частицы будут уноситься экстрагирующей жидкостью, забивать фильтрующие сита, загрязнять экстракт и т.д.
|
|
|
Процесс, осуществляемый в экстракторах непрерывного или периодического действия, является нестандартным, так как концентрация сока в любой точке обрабатываемого материала и в движущейся экстрагирующей жидкости непрерывно изменяется во времени. Следовательно, этот процесс будет описываться сложной системой дифференциальных уравнений экстракции, уравнений движения и неразрывности потока, уравнением материального баланса, а также необходимым числом функциональных соотношений, характеризующих зависимость кинетических коэффициентов от температуры, концентрации, скорости движения и т.д.
Извлечение жидкостью из пористого тела каких–то веществ, растворенных в жидкости, которая заполняет поры, определяется двумя взаимосвязанными процессами. Один из них обеспечивает подвод вещества из глубинных слоев сырья к поверхности, второй – переход этого вещества с поверхности материала в поток экстрагирующей жидкости.
Интенсивность перехода вещества с поверхности частицы в поток обусловлена разностью концентраций вещества на поверхности частицы и в потоке жидкости. Обычно закон конвективного массообмена задают упрощенно в виде закона Ньютона:
qп(t) = b[Cп(t) – Сс(t)], (1.1)
где b - коэффициент массоотдачи, м/с;
qп(t) – плотность потока вещества через время t после начала процесса с единицы поверхности частицы, (кг/м2×с);
Сп(t) – концентрация растворенного вещества в поверхностном слое в момент времени t, кг/м3;
Сс(t) – концентрация экстрагирующей жидкости (диффузионного сока) в данный момент времени, кг/м3.
Коэффициент массоотдачи b численно равен количеству вещества, отдаваемого единицей площади в единицу времени при разности концентраций вещества на поверхности тела и в окружающей среде, равной единице.
По закону сохранения массы это количество вещества должно быть равно тому его количеству, которое подводится к единице площади тела в единицу времени в результате происходящего внутри тела диффузионного процесса. Для слоев, непосредственно примыкающих к поверхностным, в соответствии с законом А. Фика можно записать:
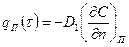 , (1.2)
, (1.2)
где D1 – коэффициент массопроводности, отражающий влияние пористой структуры тела на величину коэффициента молекулярной диффузии, м2/с;
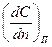 - градиент концентрации у поверхности тела, кг/м4.
- градиент концентрации у поверхности тела, кг/м4.
Очевидно,
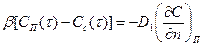 .
.
Это соотношение входит в формулировку задачи в виде граничного условия третьего рода.
Концентрация экстрагирующей жидкости Сс(t) будет изменяться в связи с тем, что пористое тело будет отдавать экстрагирующей жидкости извлекаемое вещество. Очевидно, величину Сс(t) можно выразить через среднеобъемную концентрацию` С(t) жидкости, находящейся в порах тела.
Для противоточного процесса можно записать:
V[С0 –`С (t)] = W[Ссн –`Сс (t)], (1.3)
где С0 – концентрация в порах частицы при t = 0;
Ссн – концентрация экстрагирующей жидкости, покидающей аппарат;
V – объем жидкости, находящейся в порах единицы объема тела;
W – объем экстрагирующей жидкости, приходящейся на единицу объема пористого тела.
Если учесть, что в процессе экстракции будет изменяться еще V и W, то сложность решения задачи при такой постановке значительно возрастает. Задача становится еще более трудной в том случае, когда обрабатываемый материал представляет собой полидисперсную смесь, для составляющих которой среднеобъемная концентрация будет зависеть от формы и геометрических размеров частицы.
Характеристикой дисперсности обрабатываемого материала может служить функция распределения характеристического размера частицы R:
Ф(R) = 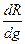 ,
,
где g – объемная или массовая доля определенной функции в полидисперсной смеси.
Если тем или иным методом получено решение дифференциального уравнения с учетом соответствующих граничных и начальных условий для среднеобъемной концентрации` С(R,t) частицы размером R, то усредненная в пределах всей совокупности частиц, образующих полидисперсную смесь, концентрация может быть получена из уравнения:
С (t) = 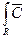 (R, t) Ф (R) dR. (1.4)
(R, t) Ф (R) dR. (1.4)
Если в полидисперсной смеси меняется и форма частиц, то решение` С(R,t) получают для той или иной формы с учетом распределения частиц, а затем с учетом объемной или массовой доли фракции определенной формы находят усредненную для всей смеси концентрацию.
Для изотропного тела при отсутствии движения жидкости в порах можно записать:
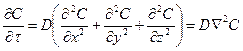 ,
,
где D – коэффициент диффузии, или концентрациопроводности (по аналогии с коэффициентом температуропроводности), м2/с.
В.М. Лысянский предложил интервально – итерационный метод расчета процесса диффузии, приняв гипотезу о возможности апроксимировать на каком – то небольшом участке процесса изменение концентрации экстрагирующей жидкости линейной зависимостью. Используя априорную информацию о величине коэффициентов концентрациопроводности и массоотдачи на каждом интервале, В.М. Лысянский определяет расчетную процедуру, как ряд последовательных расчетов каждого интервала. Результат расчета предыдущего интервала принимается за начальные условия для расчета последующего интервала. Этот метод позволяет при достаточно большом числе интервалов учесть зависимость кинетических коэффициентов от концентрации, температуры и других факторов.
Обычно задачу еще более упрощают, полагая, во – первых, что коэффициенты D и b могут быть приняты за величины постоянные, не зависящие от концентрации и температуры, во – вторых, изменение концентрации экстрагирующей жидкости определяют из опыта, апроксимируют полученные экспериментальные данные какой – либо зависимостью и вводят соответствующую функцию в граничные условия.
Некоторые авторы считают, что изменение концентрации экстрагирующей жидкости можно для некоторых экстракционных процессов описать экспоненциальной зависимостью:
Сс (t) = Ссн е --kt, (1.5)
где Ссн – концентрация экстрагирующей жидкости, покидающей аппарат, кг/м3;
k – показатель экспоненты, 1/с;
t - время, в течение которого подвергающееся обработке сырье переместится от входа в аппарат до рассматриваемой точки (сечения), с.
Для противоточного процесса, в котором частица обрабатываемого сырья может быть представлена в виде неограниченного (R3®¥) параллелепипеда, задача может быть сформулирована следующим образом:
 (t > 0; - R1 ³ x ³ R1; - R2 ³ y ³ R2);
(t > 0; - R1 ³ x ³ R1; - R2 ³ y ³ R2);
С(x, y, 0) = Сн; (1.6)

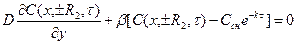
Уравнение материального баланса можно записать в виде равенства:
d`C(t)=adCc
или
d`C(t)= - adCcнe-ktdt (1.7)
где `С(t) – среднеобъемная концентрация в твердой фазе ко времени t;
a - отношение объема экстрагирующей жидкости W к объему раствора внутри материала, подвергавшегося обработке, V.
Учитывая уравнение (1.7), операционным методом можно получить решение задачи (1.6) для среднеобъемной концентрации в виде бесконечного двухмерного экспоненциального ряда, быстро сходящегося для условий реального процесса.
Ограничиваясь первым членом ряда, можно после ряда преобразований получить расчетное уравнение
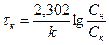 , (1.8)
, (1.8)
где tк – время, необходимое для получения заданной степени извлечения Ск/Сн;
С – остаточная среднеобъемная концентрация раствора внутри твердой фазы, удаляемой из аппарата.
Коэффициент k определяется по следующей формуле:
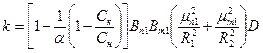 . (1.9)
. (1.9)
Здесь Bn1, Bm1, mn1 и mm1 являютсяфункциями диффузионного критерия Био 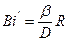 и могут быть подсчитаны по специальным формулам или взяты из соответствующих таблиц [1].
и могут быть подсчитаны по специальным формулам или взяты из соответствующих таблиц [1].
Изложенное выше свидетельствует о том, что для анализа и расчета процесса экстракции необходимо знать числовые значения коэффициентов D и b
АДСОРБЦИЯ
Адсорбция —это процесс поглощения газов или паров поверхностью твердого тела (адсорбента).
Адсорбционные процессы нашли широкое применение для очистки диффузионного сока и сиропов в свеклосахарном производстве, сиропов в крахмало-паточном производстве, очистки и стабилизации вин, осветлении соков в консервном производстве, рафинации растительных масел, стабилизации пива, очистки спирта и водоспиртовых смесей в спиртовом и ликеро-водочном производстве. Особенно велика роль адсорбции при очистки сточных вод и других отходов производства.
Адсорбция много сложнее абсорбции т.к. сопровождается рядом других процессов, однако имеет общие закономерности.
Характерной особенностью адсорбции является избирательность и обратимость. Различают физическую и химическую адсорбцию. Физическая адсорбция имеет место при взаимном притяжении молекул адсорбтива и адсорбента под действием сил Ван-дер-Ваальса. При поглощении паров адсорбция может сопровождаться конденсацией паров, при этом поры адсорбента заполняются жидкостью —происходит капиллярная конденсация, возникающая вследствие снижения давления.
Химическая адсорбция характеризуется образованием химических связей между молекулами поглощенного вещества и адсорбента, что является результатом химической реакции.
Материальный баланс непрерывной адсорбции запишется следующим образом:
L(xк-xн) = G(yн-yк),
где обозначения те же, что и в выше рассмотренных формулах.
Движущей силой процесса является разность концентраций сорбтива в газовой и равновесной фазах:
Dy = y —yр.
При адсорбции равновесная крнцентрация выразится уравнением
Фрейндлиха x = K (yр)1/n, где x —концентрация сорбтива в поглотителе; yр —равновесная концентрация в газовой фазе; К и n —постоянные для заданной температуры.
Концентрация сорбтива в газовой фазе пропорциональна его парциальному давлению, т.е. можно записать:
x = K1 p1/m.
Решая оба уравнения относительно yp, получим:
yp = xn/Kn = K2 xn.
Данное уравнение характеризует кривую
Y равновесия, которую называют изотермой
├ ── ─ ─ ─ ─ ─ ─ адсорбции. Согласно уравнению изотерма
Y ││ адсорбции является параболой и может
││ а быть представлена графически.Для неп-
│ │ │ │ рерывного процесса рабочая линия может
│ │ быть построена аналогично процессу аб-
Y │─ ─┐ │ │ сорбции. Движущая сила на диаграмме Y‑X
│ в представляется отрезком а‑в, лежащем
└────┴──────────┴─── X между линией равновесия и рабочей
X ───── X линией.
МАССОПЕРЕДАЧА В ПРОЦЕССЕ АДСОРБЦИИ
Основное уравнение массопередачи имеет следующий вид:
M = K DC t F,
где М —масса адсорбированного вещества; К —коэффициент массопередачи; DC —средняя разность концентраций; t —время; F —площадь поверхности абсорбента.
При расчетах процесса адсорбции удобнее рассматривать объемный коэффициент массопередачи:
КYV = М/(DY.V)
где DY = Y1-Yp —движущая сила процесса, здесь Y1- концентрация влаги на входе в аппарат,кг/кг; Yp- равновесная концентрация, кг/кг; V = НSe —объем адсорбента, м3, здесь Н —высота слоя, м; S —площадь сечения аппарата, м2; e —порозность слоя (e=0,4).
Для процесса адсорбции диффузионные сопротивления внутри твердой фазы малы по сравнению с внешним диффузионным сопротивлением, поэтому, с некоторым допущением принимают КYV=bYV, где bYV —объемный коэффициент масоотдачи.
Значение коэффициента массоотдачи bYV можно определить по следующим уравнениям подобия:
Для неподвижного слоя адсорбента
Nu = 0,395 Re0,64 Pr0,33 для Re > 30;
Nu = 0,725 Re0,47 Pr0,33 для Re = 2 — 30;
Nu = 0,515 Re0,85 Pr0,33 для Re < 2;
где Nu = bYVd2/D —диффузионное число Нуссельта; d — эквивалентный диаметр частиц адсорбента, м; D —коэффициент диффузии; Re — число Рейнольдса (Re = 4G/(s.m.g); G —массовый расход паровоздушной смеси, кг/с; s —удельная поверхность зерен адсорбента, м2/м3; m —динамическая вязкость паровоздушной смеси, Па.с; g —ускорение свободного падения, м/с2; Pr = n/D —число Прандтля; n —кинематическая вязкость.
Для взвешенного слоя
Nu = 46,25.10— Re1,65,
где Re = wodr/m —число Рейнольдса.
ТИПЫ АДСОРБЕНТОВ
Наибольшее распространение в пищевой промышленности в качестве адсорбентов нашли активированный уголь, костяной уголь, целлюлозная масса, силикагель и др.
Основными характеристиками адсорбентов являются:
1. Удельная поверхность —величина поверхности приходящаяся на единицу массы или объема адсорбента;
2. Активность адсорбента —предельное количество вещества, которое может поглотить единица массы адсорбента.
Адсорбенты характеризуются также плотностью, пористостью, эквивалентным диаметром гранул, гранулометрическим составом и механической прочностью.
Различают истинную rи, кажущуюся rк и насыпную rн плотность гранул.
Истинная плотность rи —масса единицы объема вещества из которого состоит адсорбент.
Кажущаяся плотность rк —отношение массы гранулы к ее объему.
Насыпная плотность rн —масса единицы объема слоя.
Пророзность слоя адсорбента это доля объема слоя не занятая гранулами:
eс = 1 —(rн/rк).
Пористость гранул это объемная доля пустот в грануле:
eг = 1 —(rк/rи).
ДЕСОРБЦИЯ
Десорбция —процесс удаления поглощенных веществ из адсорбента, т.е. процесс обратный адсорбции. Аналогично десорбции абсорбированых веществ, рассмотренный выше, процесс можно осуществить повышением температуры адсорбента, понижением давления над ним, продувкой нагретым газом или перегретым водяным паром.
Так регенерация активированного угля осуществляется водяным паром, силикагель регенерируется нагреванием до 300оС.
СУШКА И КОПЧЕНИЕ
Сушка —способ консервирования путем тепловой обработки продукции при котором удаляется значительное количество влаги, что замедляет жизнедеятельность бактерий и повышает сроки хранения. При копчении процесс сушки сопровождается замещением удаленной влаги компонентами дыма, обладающими антисептическими свойствами, это повышает стойкость продуктов при хранении и придает им специфический ароматный вкус.
В качестве сушильных агентов при сушке применяются воздух и дымовые газы. Для сушки пищевой продукции применяют только воздух. Для копчения продуктов применяют дымовоздушную смесь. При этом дым вырабатывается в устройствах называемых дымогенераторами.
Влага, находящаяся в продукте, подразделяется на несвязанную (поверхностную и капилярную) и связанную (осмотическую и химическую). При сушке и копчении удаляется несвязанная влага.
Химически связанная влага представляет собой прочно связанную с материалом в точных количественных соотношениях. Как правило химически связанная влага при сушке не удаляется.
Физико-химическими силами связана адсорбционная и осмотическая влага. Адсорбционная влага асорбируется поверхностью капиляров. В процессе сушки адсорбционная влага удаляется лишь частично. Осмотическая влага, находящаяся внутри клеток, удаляется быстрее адсорбционной.
Физико-механически удерживается влага внутри капилляров (капиллярная) и на поверхности материала (поверхностная). Эта влага обладает наименьшей энергией связи и называется свободной или несвязанной и удаляется из продукта в первую очередь.
Сушка осуществляется двумя основными способами:
нагреванием влажных материалов через твердую непроницаемую перегородку или контактной сушкой;
нагреванием влажных материалов путем непосредственного контакта с теплоносителем или газовая и воздушная конвективная сушка.
Иногда тепло подводится материалу токами высокой частоты (диэлектрическая сушка) или инфракрасными лучами (инфракрасная сушка). Сушка при глубоком вакууме в условиях отрицательных температур называется сублимационной сушкой. Для рыбной промышленности характерна одна из разновидностей сушки —вяление —медленное подсушивание и созревание слабосоленой рыбы при температуре сушильного агента не выше 35оС.
СВОЙСТВА ВЛАЖНОГО МАТЕРИАЛА И СУШИЛЬНОГО АГЕНТА
Влажный материал состоит из влаги и сухих веществ. Для оценки влаги в материале используют понятия: влажность материала относительно общей массы w, влажность материала относительно абсолютно сухого метериала wc и влагосодержание материала u.
Влажность материала относительно общей массы —это отношение массы влаги к общей массе:
w = [Mв/(Mс+Mв)]100, %,
где Mв —масса влаги в материале, кг; Mс —масса абсолютно сухого материала, кг.
Влажность материала относительно абсолютно сухого материала —это отношение массы влаги к массе его сухой части:
w = [Mв/Mс]100, %.
Влагосодержание материала —это отношение массы влаги к массе материала, относительно общей массы:
u = Mв/(Mс+Mв),кг/кг;
и относительно абсолютно сухого материала:
uc = Mв/Mс,кг/кг.
В качестве сушильного агента при сушке продуктов обычно применяют влажный воздух, т.е. смесь сухого воздуха и водяного пара. Свойства влажного воздуха как сушильного агента определяются абсолютной и относительной влажностью, влагосодержанием, энтальпией, температурой и др.
Абсолютная влажность —это масса водяного пара, содержащаяся в 1 м3 влажного воздуха и численно равная плотности пара приданной температуре.
Относительная влажность воздуха —это отношение абсолютной влажности rп к максимально возможной rн при данной температуре:
j = rп/rн.
Плотность пара при постоянной температуре пропорциональна парциальному давлению, поэтому можно записать:
j = pп/pн и pп = jpн.
Относительная влажность характеризует степень насыщения воздуха водяным паром и выражается в процентах.
Влагосодержание воздуха —это масса водяного пара, содержащаяся в воздухе, отнесенная к 1 кг сухого воздуха. Влагосодержание можно определить по формуле
x = 0,622(jpн/p —jp),
где p —общее давление.
Удельная энтальпия определяется как сумма удельных энтальпий
1 кг сухого воздуха Iс.в. и энтальпии Iп содержащегося в нем водяного пара:
I = Iс.в. + xIп.
Удельную энтальпию влажного воздуха можно так же определить по формуле:
I = t + x(2500 + 1,842t),
где 2500 —теплота парообразования при 0 oC, кДж/кг.
Для расчетов процесса сушки и копчения удобнопользоваться I‑x диаграммой, построенной Л.К.Рамзиным в 1918 году. Диаграмма построена в косоугольной системе координат с углом 135о между осями.На диаграмме нанесены линии постоянной температуры, энтальпии, влагосодержания и пучек кривых постоянной относительной влажности, выходящих из точки с координатами x=0, t=-273,15 oC.
С помощью диаграммы можно проследить изменение состояния влажного воздуха в различных процессах. При нагревании процесс проходит по линии x=Const от начальной до конечной изотермы вверх, при охлаждении —вниз. При охлаждении воздуха до влажности 100%, он становится насыщеным. Температура, при которой воздух с данным влагосодержанием имеет влажность 100%, называется точкой росы. При дальнейшем охлаждении воздуха часть водяного пара будет выпадать в виде конденсата, воздух будут осушаться, а процесс пойдет по кривой относительной влажности 100% в сторону уменьшения влагосодержания. Температура воздуха, при которой достигается полное равновесие системы воздух-вода, называется температурой мокрого термометра. Процесс адиабатического охлаждения воздуха изображается на диаграмме прямой очень близкой к линии I=Const, походящей через исходную точку. Температура мокрого термометра определяется в точке пересечения линии I=Const с линией j=100%.
Процесс смешивания двух порций воздуха, имеющих различные состояния находится по “правилу рычага”. Пусть М —порция воздуха одного состояния в количестве LM смешивается с порцией воздуха состояния № в количестве LN. Состояние смеси представиться точкой К, лежащей на прямой MN, соединяющей точки M и N. Положение точки К определится соотношением MK/NK=LN/LМ.
Равновесная влажность.
При взаимодействии влажного воздуха и материала влага из воздуха будет переходить в материал или наоборот до достижения равновесиия. Влажность материала в этом равновесном состоянии называется равновесной влажностью. Равновесная влажность является функцией парциального давления водяного пара при данной температуре. Меняя парциальное давление при постоянной температуре можно получить кривую, называемую изотермой сорбции влаги.
Для большинства материалов равновесная влажность не зависит от температуры, а зависит только от относительной влажности воздуха. Следователь, что при помощи сушильного агента с определенной относительной влажностью невозможно удалить всю влагу из материала. Материал будет характеризоватья равновесной влажностью. Поэтому вводится понятие удаляемая влага:
Wуд = W —Wр.
где W —влажность материала, %; Wр —равновесная влажность, %.
КИНЕТИКА СУШКИ
При сушке влага перемещается в материале в направлении от центра к периферии, где материал омывается сушильным агентом. Это диффузионный процесс, движущей силой которого является разность концентраций влаги в различных слоях материала. Однако этот процесс осложняется тепловым воздействием. Основное уравнение влагопроводности выглядит аналогично уравнению Фурье
mw = —KwF(dc/dx)t,
где mw —количество влаги, прошедшее через поверхность F при градиенте концентрации dc/dx за время t; Kw —коэффициент влагопроводности, зависящий от связи влаги с материалом и от вида материала.
Влага может перемещаться в материале как в виде жидкости (осмотическая влага), так и в виде пара (адсорбционно-связанная влага).
Наряду с концентрационным при сушке имеет место и температурный градиент, в результате которого наблюдается действие термовлагопроводности. Влага при этом перемещается в направлении потока тепла, т.е. внутрь материала. Количество влаги, перемещаемое за счет термовлагопроводности можно определить по формуле:
mt = —KtF(dt/dx)t,
где mt —количество влаги, прошедшее через поверхность F при градиенте температуры dt/dx за время t; Kt —коэффициент, аналогичный коэффициету Кw.
Суммарной количество влаги, перемещенное влагопроводностью и термовлагопроводностью, при обычной конвективной сушке равно разности
m = mw —mt
так как направление потоков влаги противополрожно.
КРИВЫЕ СУШКИ И КРИВЫЕ СКОРОСТИ СУШКИ
Сушка состоит из трех этапов: перемещения влаги внутри материала из центра к поверхности, парообразования и перемещения пара от поверхности в окружающую среду.
Движущей силой диффузии влаги в окружающую среду является разность парциальных давлений водяного пара на поверхности материала, в пограничном слое рн и в окружающей среде рв:
Dр = рн —рв.
Количество продиффундированного пара
m = B(рн —рв)Ft,
где В —коэффициент испарения; F —площадь поверхности
|
|
|


